Les différents décomptes présentés dans le 1er volet peuvent paraître arbitraires ; il est cependant possible de montrer qu’ils possèdent des justifications théoriques relativement simples. Pour les présenter, on effectuera par la suite une fragmentation du complexe qui sépare soit le métal et l’ensemble des ligands, soit un fragment métallique et un seul ligand.
Le métal de transition possède neuf Orbitales Atomiques (OA) de valence : par exemple pour un métal de la première série de transition, il s’agit des OA 4s, 3d, et 4p. Afin de simplifier l’analyse, on supposera que chaque ligand interagit avec le métal par l’intermédiaire d’une seule orbitale comme par exemple le ligand H.
Ce deuxième article est accompagné de trois autres volets :
- 1er volet, donnant la définition de diverses grandeurs (nombre total d’électron, nombre d’oxydation, configuration dn) et la façon de les calculer ;
- 3ème volet, montrant les applications des décomptes électroniques aux complexes de borohydrures et au complexe TiCl4 ;
- 4ème volet, traitant du phénomène de rétro-donation et des complexes de dihydrogène.
Justifications théoriques des décomptes présentés précédemment
La paire de liaison est attribuée au ligand
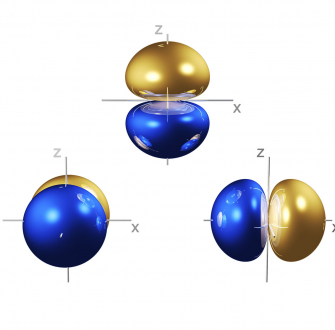
Tous les métaux du bloc d sont très peu électronégatifs : dans l’échelle de Pauling, leur électronégativité est comprise entre 1,22 (Y) et 2,54 (Au). Ces valeurs sont comprises entre celles du lithium (0,98) et du carbone (2,55). En conséquence, les ligands seront, dans leur grande majorité, plus électronégatifs que les métaux. En terme orbitalaire, cela se traduit par des OA de valence métalliques d’énergies supérieures aux orbitales occupées des ligands. L’interaction orbitalaire entre le métal et les ligands dans le cas d’un complexe octaédrique modélisé par MH6 est présentée dans la Figure 1. Les OM peuvent être établies à l’aide de la théorie des groupes1, sans que son utilisation soit indispensable2.
Il se forme six Orbitales Moléculaires (OM) liantes (1a1g, 1t1u et 1eg) et six antiliantes (2eg, 2t1u et 2a1g) ; trois orbitales (t2g) ne sont pas perturbées par cette interaction et restent strictement non-liantes dans ce diagramme. Comme les orbitales des fragments sont d’énergie très différentes, les OM résultantes sont polarisées, les liantes sur les ligands et les antiliantes sur le métal. Les électrons décrivant les liaisons métal-ligand sont placés dans les OM liantes, principalement localisées sur le ligand. On simplifie ce résultat en attribuant formellement aux ligands les électrons des liaisons.

Figure 1. Construction des OM d’un complexe octaédrique modélisé par MH6.
La configuration dn
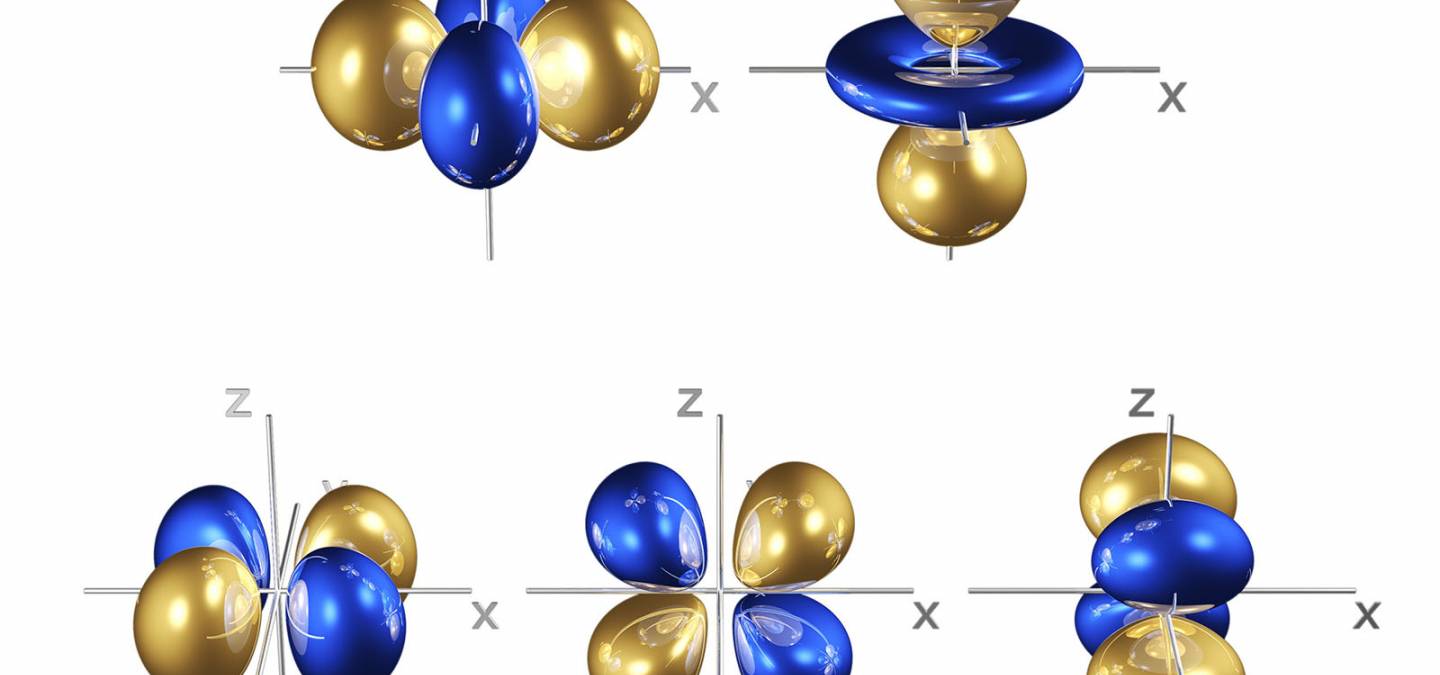
Dans le cas d’un complexe octaédrique MH6, les six OM liantes (1a1g, 1t1u, 1eg) sont, comme vu précédemment, principalement localisées sur les ligands. Immédiatement au-dessus, on trouve cinq orbitales, trois non-liantes et deux antiliantes qui se développent majoritairement (2eg) voire exclusivement (t2g) sur les OA d du métal ; cet ensemble constitue le « bloc d » de ce complexe (Figure 2).

Figure 2. OM du bloc d d’un complexe octaédrique. Sur la partie droite on a donné la forme de ces OM issues de la base de données OrbiMol3.
Le nombre total d’électrons de ce complexe est égal à Nt = m + 2l + x – q. Parmi ceux-ci, (2l + 2x) viennent occuper les (l + x) OM liantes (ici (l + x) = 6). Les électrons restants sont au nombre de Nt – 2l – 2x = m – x – q = n et se placent dans les OM les plus basses en énergie au-dessus des OM liantes. Il s’agit dans ce cas des OM du bloc d et il est légitime de parler d’une configuration dn.
Ce résultat, établi pour un complexe octaédrique, est général et peut s’appliquer à tous les complexes, quelle que soit leur géométrie.
Un ligand Ln est considéré comme L
Ce point nécessite une analyse théorique un petit peu plus poussée. Prenons l’exemple d’un ligand H2O dans un complexe octaédrique, modélisé par H5M(H2O). Pour simplifier l’analyse, on supposera que la molécule d’eau se place dans un plan MH3 ; c’est la géométrie effectivement observée dans le complexe Cr(H2O)62+. La construction des OM de ce complexe s’effectue en utilisant une fragmentation en H5M et H2O4 (Figure 3). Afin de simplifier la construction du diagramme, on se limite aux orbitales du bloc d du fragment métallique sur H5M et aux orbitales décrivant les paires libres sur H2O. L’analyse de la symétrie des différentes orbitales de fragment permet de déterminer les interactions possibles entre les orbitales. On utilisera deux plans de symétrie, le plan de la feuille, P1 et celui, P2, horizontal perpendiculaire au plan de la feuille5 (S et A indiquent des OM respectivement symétriques ou antisymétriques par rapport au plan considéré).

Figure 3. Construction des OM du complexe MH5(OH2).
L’interaction de l’OM SS de H2O avec la plus haute en énergie de MH5 dx² - y² est négligeable bien que permise par symétrie : en effet l’orbitale hybride SS de H2O pointe dans les plans nodaux de l’orbitale dx² - y². Le recouvrement de ces deux OM provient ainsi uniquement des contributions sur les atomes d’hydrogène : il est donc est très faible. Les deux orbitales AA et AS de MH5 n’ont pas de partenaires de même symétrie sur H2O et restent donc non-liantes dans ce diagramme. Il existe donc deux interactions notables dans ce complexe : celles mettant en jeu d’une part deux orbitales SS et d’autre part deux orbitales SA.
La première interaction met en jeu une OM occupée de H2O avec une OM généralement vacante dans le fragment MH5 ; elle est stabilisante et décrit une liaison entre MH5 et H2O. Les deux électrons mis en jeu ici sont, avant interaction, localisés sur le ligand. Une fois l’interaction prise en compte, ils occupent une OM en partie délocalisée sur le métal. Il y a ainsi un transfert partiel d’électrons du ligand vers le métal. On parlera « d’interaction de donation » du ligand vers le métal (L → M). Une telle interaction est toujours présente lorsqu’un ligand se lie à un métal de transition. Il est possible de préciser « interaction de donation s » car les deux orbitales qui interagissent possèdent la symétrie de révolution autour de l’axe M-O.

La seconde interaction met en jeu une orbitale d pure du métal et la seconde paire libre de H2O. Cette dernière est occupée dans la configuration fondamentale de H2O alors que la première peut être soit occupée, soit vacante. On considérera ici deux cas particulièrement fréquents : celui des complexes d6 (l’orbitale est occupée) ou d0 (elle est vacante).
Dans le cas des complexes d0, l’interaction conduit à un second transfert du ligand vers le métal analogue à celui étudié dans le cas de l’interaction de donation. Le ligand H2O est ainsi un donneur de quatre électrons, deux dans l’orbitale SS et deux dans l’orbitale SA. On parle alors d’interaction de « donation s » (SS) et de « donation p » (SA).
Dans le cas des complexes d6, l’interaction entre les orbitales SA met en jeu quatre électrons. L’occupation de l’orbitale liante traduit un transfert de H2O vers le métal comme il vient d’être vu. Mais ici, un second transfert existe également : les deux électrons occupant l’orbitale d (purement métallique) viennent peupler l’orbitale antiliante qui est en partie délocalisée sur le ligand. Il existe ainsi un transfert inverse, du métal vers le ligand (M → H2O). Il est possible de montrer que les deux transferts s’annihilent : globalement seuls deux électrons sont transférés via l’interaction entre orbitales SS et le ligand H2O se comporte comme un ligand à deux électrons.

D’une façon générale, l’interaction de donation existe toujours entre un ligand et le métal auquel il est lié. D’autres interactions de donation peuvent exister comme il vient d’être vu mais elles dépendent de la configuration dn du métal. C’est la raison pour laquelle un site de coordination Ln est considéré comme un site L. Pour les mêmes raisons, un site LnX est considéré comme un site X. C’est l’analyse au cas par cas qui permet de déterminer plus précisément le nombre d’électrons apportés par le ligand.
La règle des dix-huit électrons
Dans un grand nombre de cas, on trouve que le nombre total d’électrons d’un complexe, Nt, est égal à 18. Ce résultat peut être justifié par une analyse théorique simple. Considérons un complexe quelconque où le métal est entouré de p : ce complexe sera modélisé par MHp. La structure électronique de ce complexe peut être établie schématiquement en analysant les interactions se développant entre les OA du métal et les p orbitales du fragment Hp ; un exemple a été donné dans la Figure 1 dans le cas de MH6 octaédrique.
Diverses interactions s’établissent entre les neuf OA du métal et les p orbitales des ligands. Si le complexe est stable, c’est qu’il existe p OM liantes qui, globalement, décriront les p liaisons métal-ligand. Or, à chaque OM liante correspond sa contrepartie antiliante. Il y a donc nécessairement p OM liantes et p OM antiliantes dans le diagramme d’OM du complexe.
Cependant, sur les fragments, on a neuf OA sur le métal et p orbitales sur Hp. Il y a donc (9 + p) orbitales mises en jeu dans la formation des OM du complexe. Parmi celles-ci, seules 2p ont été obtenues. Il reste donc (9 – p) orbitales à déterminer. Ce sont des orbitales non-liantes, métalliques. Par exemple, dans le complexe MH6, ce sont les trois (9 – 6) OM non liantes t2g (voir Figure 1). Le diagramme dans le cas général est donné dans la Figure 4.

Figure 4. Construction qualitative des OM d’un complexe MHp.
Le remplissage s’effectue de la façon suivante : les p orbitales liantes doivent être remplies afin de décrire les p liaisons entre le métal et les ligands. Le nombre minimal d’électrons dans un complexe MHp est donc de 2p électrons. À notre connaissance, il n’existe pas d’exception à cette règle.
Il est également possible de placer des électrons dans les (9 – p) OM non liantes du complexe sans détruire (ou affaiblir) les liaisons obtenues par l’occupation des OM liantes. Lorsque toutes ces orbitales sont remplies, le nombre d’électrons est égal à 2p (OM liantes) plus 2*(9 – p) (OM non liantes), soit 18 électrons. C’est l’origine de la règle des 18 électrons. On remarquera qu’il s’agit d’un nombre maximal d’électrons afin que les OM antiliantes soient vacantes ; des complexes possédant un nombre inférieur d’électrons sont bien sûr tout à fait envisageables.
Peut-on obtenir des complexes à plus de 18 électrons ?
Le peuplement des OM antiliantes d’un complexe n’est pas strictement impossible. On détaillera deux cas où des complexes à plus de 18 électrons sont stables. Le premier cas est celui du nickelocène, Ni(h5-C5H5)2 qui possède vingt électrons. Les OM de ce complexe sont analogues à celles du ferrocène (complexe à 18 électrons) : par énergie croissante, on trouve six OM liantes (qui décrivent six liaisons entre le métal et les ligands), puis le bloc d constitué de trois OM approximativement non liantes (deux puis une) et deux OM antiliantes. Ce bloc d représenté dans la figure 5, est proche de celui de l’octaèdre, la dégénérescence des trois OM non liantes t2g de l’octaèdre étant levée.

Figure 5. blocs d du ferrocène et du nickelocène.
Dans le ferrocène, seules les OM non liantes du bloc sont occupées. Dans le nickelocène, deux électrons supplémentaires viennent occuper les premières OM antiliantes. L’état fondamental est un triplet, les deux électrons se répartissant sur ces deux OM dégénérées avec le même spin. On a alors deux liaisons à trois électrons (deux électrons dans l’OM liante et un dans l’OM antiliante) situation analogue à celle observée dans le système p du dioxygène. Le caractère antiliant des OM monooccupées dans le nickelocène se traduit par une variation des distances M-C qui augmentent de 206 à 220 pm lorsque l’on passe du fer au nickel, alors que les rayons des atomes varient en sens inverse (de 140 à 135 pm)1.
D’autres exemples sont trouvés dans les complexes à champ faible : par exemple le complexe hexaaquazinc (II), Zn(H2O)62+, possède 22 électrons. Dans ce cas, les interactions se développant entre le cation métallique et les molécules d’eau sont essentiellement électrostatiques et non d’origine orbitalaire.