Le décompte d’électrons présenté dans les précédents volets est très efficace et permet par exemple de déterminer la géométrie des complexes de borohydrures (ou tétrahydroborates), ce qui sera présenté dans une première partie. Cependant, certains points restent difficilement compréhensibles : par exemple, le complexe TiCl4 possède un nombre total d’électrons de valence égal à huit, ce qui en fait un complexe très déficient par rapport à la règle des 18 électrons ; on s’attendrait à une réactivité importante de ce composé au regard de cette déficience. Or ce complexe est relativement stable et utilisé comme catalyseur acide. Une analyse plus précise de ce composé devrait permettre de lever cette apparente contradiction.
Ce troisième article est accompagné de trois autres volets :
- 1er volet, donnant la définition de diverses grandeurs (nombre total d’électron, nombre d’oxydation, configuration dn) et la façon de les calculer ;
- 2ème volet, apportant des justifications théoriques et se terminant par l'établissement de la règle des 18 électrons ;
- 4ème volet, traitant du phénomène de rétro-donation et des complexes de dihydrogène.
Le ligand borohydrure
Ce ligand peut adopter trois modes de coordination, η1, η2 ou η3, selon qu’un, deux ou trois atomes d’hydrogène se placent en pont entre le métal et le bore. Il est alors considéré comme donneur de deux, quatre ou six électrons ; ce qui est particulièrement intéressant dans ce cas est que le changement du nombre d’électrons transférés se traduit par un changement de géométrie qui est observable.
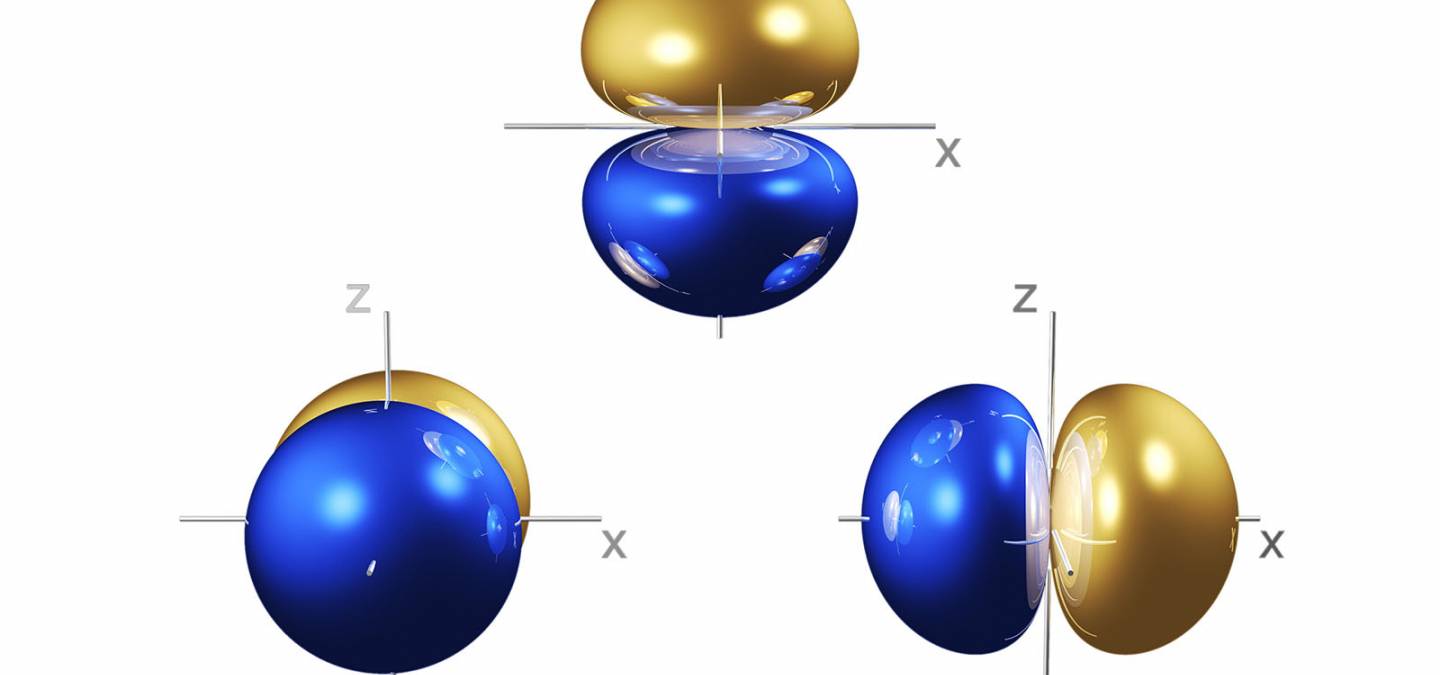
La justification théorique de ce décompte se comprend facilement à partir du diagramme d’Orbitales Moléculaires (OM) de BH4-. Outre une orbitale liante, combinaison en phase de l’Orbitale Atomique (OA) 2s du bore avec l’orbitale adaptée à la symétrie sur les atomes d’hydrogène1, le borohydrure possède trois orbitales liantes dégénérées doublement occupées. Ces OM étant dégénérées, on peut utiliser deux jeux d’OM différents selon le mode de coordination. L’interaction de ce ligand avec un métal de transition peut alors être visualisée simplement (Figure 6) :
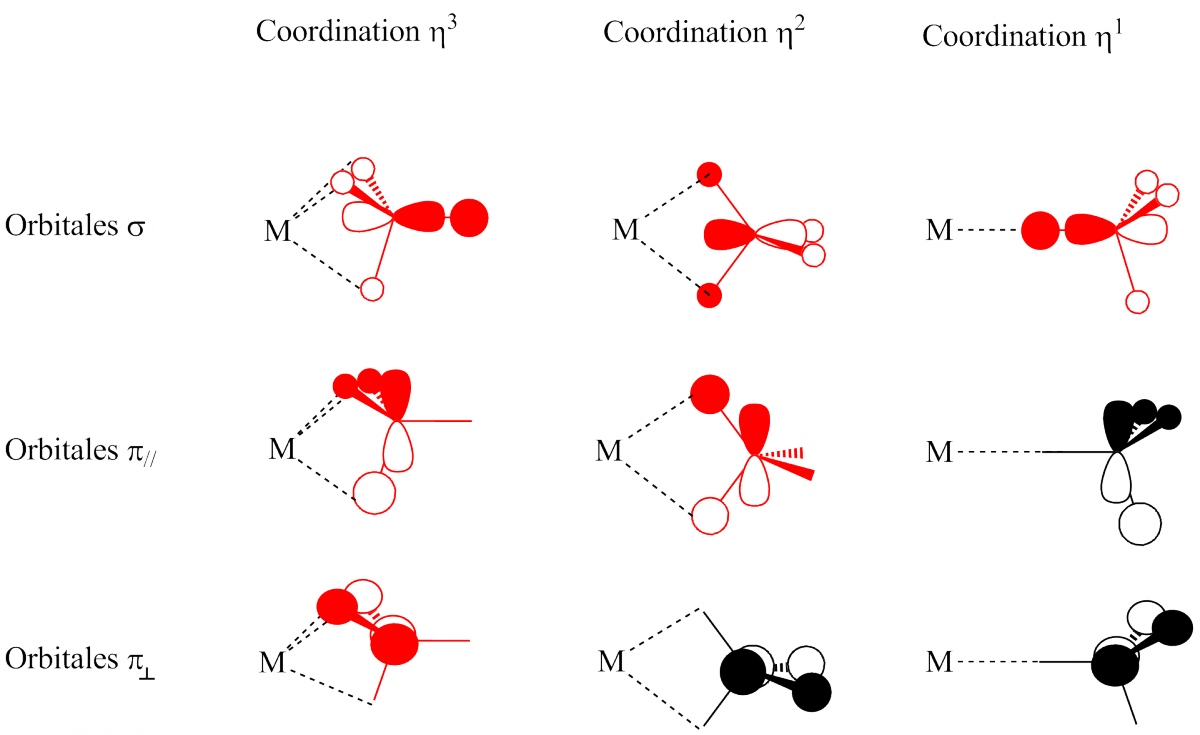
Figure 6. OM du borohydrure interagissant avec le métal selon le mode de coordination.
Il n’y a d’interaction notable de ces OM avec les OA du métal que dans le cas où les coefficients sur les atomes d’hydrogène en pont sont différents de zéro. C’est le cas des trois OM dans le cas de la coordination η3, de deux pour la coordination η2 et d’une seule pour la coordination η1 (Figure 6). On trouve ainsi que ce ligand est à six, quatre ou deux électrons selon le mode de coordination adopté. La géométrie du complexe de borohydrure est alors facilement déterminée en appliquant la règle des 18 électrons.
Un premier exemple est donné dans la chimie du cuivre : le complexe Cu(PR3)2(BH4) a été caractérisé ; dans le décompte ionique, il s’agit du fragment Cu(PR3)2+ lié à l’anion BH4-. Le fragment métallique possède 14 électrons (Nt = 11 + 2*2 – 1, voir partie I). Pour atteindre 18 électrons, le borohydrure doit apporter quatre électrons au métal et donc se coordonner selon un mode η2. C’est ce qui est observé expérimentalement. Dans un autre complexe, Cu(PR3)3(BH4), le fragment métallique possède 16 électrons et le borohydrure doit être en coordination η1, ce qui correspond bien à la structure observée. De tels décomptes permettent également de prédire que la coordination de BH4- doit être η2 dans le complexe Cp2Nb(BH4).
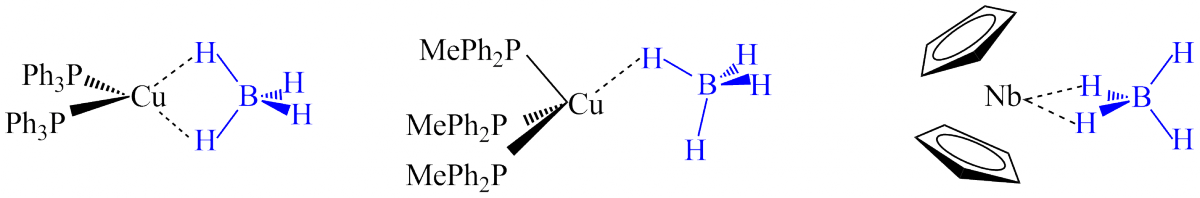
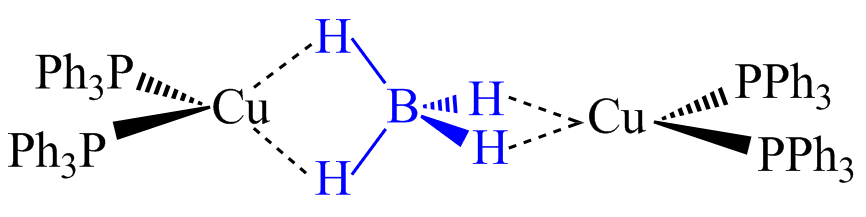
Des décomptes analogues permettent également de déterminer le mode de coordination du borohydrure dans des structures plus compliquées impliquant plusieurs métaux de transition. Ainsi, dans le dimère (PPh3)2Cu(BH4)Cu(PPh3)2+, le borohydrure se place en pont entre les deux atomes de cuivre. Chaque cuivre est au degré I et chaque fragment métallique (PPh3)2Cu+ possède 14 électrons. Le borohydrure doit apporter quatre électrons à chacun de ces fragments et se place dans une coordination η2-η2 entre les deux cuivres.
Ce décompte d’électrons s’applique également lorsque le borohydrure se lie à un atome du groupe principal. C’est alors la règle de l’octet (et non plus celle des 18 électrons) qui permet de trouver la coordination optimale de BH4-. Ainsi, dans le complexe Be(BH4)2, on a formellement deux ligands BH4- qui interagissent avec Be2+. Comme le cation central ne possède pas d’électron de valence, les deux borohydrures doivent lui apporter huit électrons et doivent donc se placer chacun en coordination η2.
De plus, l’analyse orbitalaire de ce composé permet de prévoir la conformation la plus stable entre les géométries D2h et D2d.

Dans la géométrie D2h, seules les orbitales σ et π// interagissent avec le cation Be2+. Les combinaisons en phase (σ+) et en opposition de phase (σ-) des borohydrures peuvent interagir respectivement avec les orbitales 2s et 2pz du béryllium. Quatre électrons sont ainsi transférés formellement des deux borohydrures vers Be2+. De même, la combinaison en phase des orbitales π//+ peut interagir avec l’orbitale 2px. En revanche, la combinaison en opposition de phase (π//-) ne peut pas interagir avec une OA 2p du bore (elle a la même symétrie que l’orbitale 3dxz du béryllium, qui n’est pas une orbitale de valence). Dans ce complexe, le béryllium possède formellement six électrons.
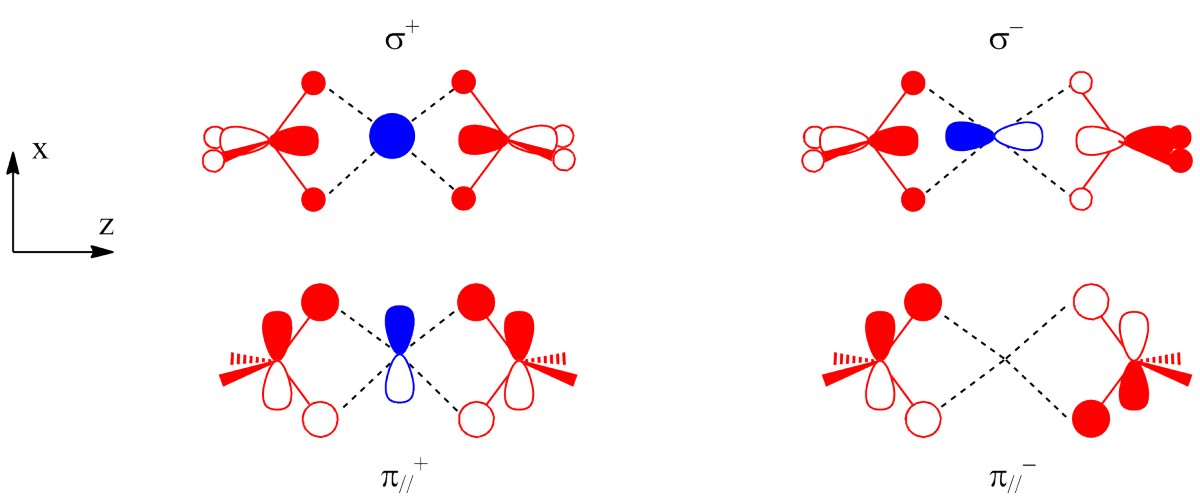
Les interactions dans la géométrie D2d, sont représentées ci-dessous : les deux premières interactions (avec σ+ et σ-) sont pratiquement les mêmes que dans le cas précédent. Dans cette géométrie, deux orbitales π peuvent interagir, chacune avec une des deux orbitales 2px et 2py. Il y a ainsi huit électrons transférés et cette géométrie est plus stable que la précédente, résultat en accord avec les données expérimentales.
Le ligand chlorure
Reprenons l’exemple de TiCl4 présenté dans l’introduction ; le métal étant de configuration d0, le ligand chlorure peut se comporter comme un ligand X, LX ou L2X (voir précédemment). On a ainsi trois décomptes possibles pour ce complexe :
- si Cl = X, alors Nt = 4 + 4*1 = 8 ;
- si Cl = LX, alors Nt = 4 + 4*3 = 16 ;
- si Cl = L2X, alors Nt = 4 + 4*5 = 24.
On n’obtient pas de décompte à 18 électrons, quelle que soit la nature du ligand chlorure.
C’est l’utilisation de la théorie des groupes qui permet de calculer plus précisément le nombre d’électrons dans ce complexe. Le complexe TiCl4 est tétraédrique, le groupe de symétrie étant Td. Les OA de valence du titane sont des bases des Représentations Irréductibles (RI) T2 (4p), A1 (4s) et (E ⨁ T2) (3d). Si l’on se limite aux seules orbitales atomiques 3p des atomes de chlore, les RI associées aux combinaisons de ces OA sont données par la relation suivante1 :
(A1 ⨁ T2) ⨂ T2 = A1 ⨁ E ⨁ T1 ⨁ 2T2
Considérons la fragmentation suivante du complexe : l’atome de titane d’une part et les quatre atomes de chlore d’autre part. Dans un décompte ionique, le titane est chargé positivement quatre fois et chaque ligand chlore est anionique. Toutes les OA du titane sont ainsi vacantes et toutes celles des chlorures doublement occupées. L’analyse précédente dans le cadre de la théorie des groupes montre que chaque OA du titane peut interagir avec une orbitale de symétrie adaptée sur (Cl-)4. Il y a donc formellement :
- deux électrons transférés vers le titane via l’interaction des orbitales A1 ;
- quatre électrons transférés vers le titane via l’interaction des orbitales E ;
- douze électrons transférés vers le titane via la double interaction des orbitales T2.
Au total, ce sont donc 18 électrons qui sont transférés des ligands chlorures vers le titane ; on remarquera que les six électrons qui occupent les orbitales de symétrie T1 sur (Cl-)4 ne trouvent pas d’orbitales de même symétrie sur le titane. Ils restent donc non liants sur les chlorures et décrivent trois paires libres sur les atomes de chlore. Le complexe TiCl4 est donc un complexe à 18 électrons, ce qui rend compte de sa stabilité. On se trouve donc avec trois paires libres apportées par quatre ligands chlorures ; ce résultat parait impossible à établir sans l’aide de la théorie des groupes.
Une analyse tout-à-fait similaire montre que le complexe Hf(η3-BH4)4 possède également 18 électrons car les trois orbitales des borohydrures qui interagissent ont la même symétrie que les trois orbitales 3p des atomes de chlore.
Remarque : le ligand Cl pourrait-il être un ligand L3X ?
La structure de Lewis indique que, effectivement, le chlore possède sept électrons de valence qui sont susceptibles d’être transférés. Pourquoi n’a-t-on considéré que deux des trois paires libres de cet atome ?
Une première réponse consiste à dire que les énergies des OA 3s du chlore sont basses en énergie et, en conséquence, n’interagissent que très faiblement avec les OA d’un métal de transition. Cet argument est juste (les OA 3s se situent à environ -30 eV et les OA 3p à -15 eV) mais d’autres raisons (cette fois-ci valides vis-à-vis de tous partenaires) le renforcent.
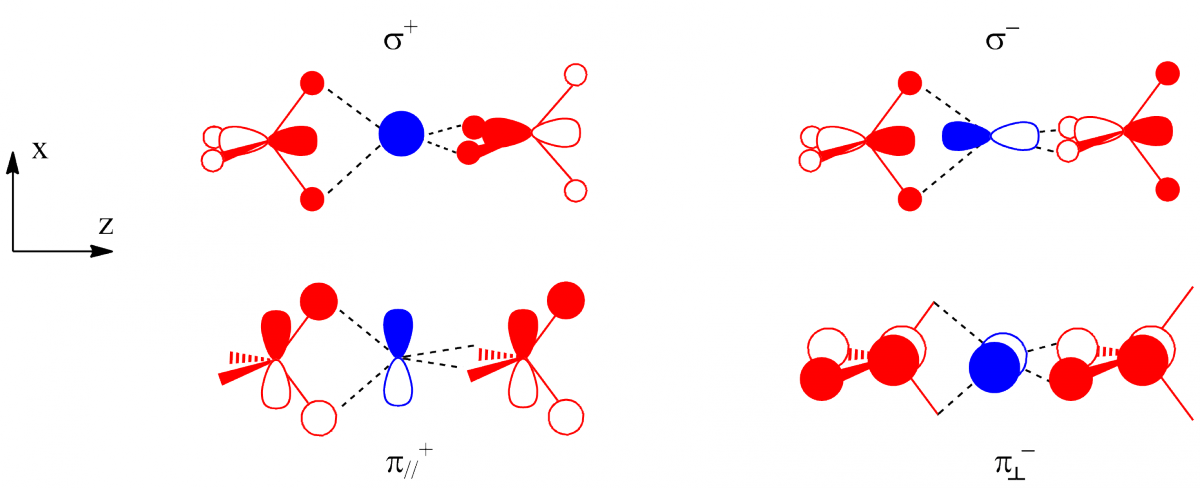
Une analyse un peu plus poussée consiste à établir l’interaction entre le bloc d d’un fragment métallique, par exemple MH5 (d0), et un chlorure (Figure 2). Trois orbitales sont axiales (de symétrie A1 dans le groupe de symétrie de ce complexe qui est C4v) dans ce diagramme d’interaction : l’orbitale dz² sur MH5, les orbitales 3s et 3pz sur le chlorure (orbitales représentées en bleu dans la Figure 7). Il se produit ainsi une interaction à trois orbitales qui forme une OM liante 1a1 de basse énergie, une OM pratiquement non-liante 2a1 d’énergie intermédiaire et une OM antiliante 3a1 haute en énergie. Seules les OM 1a1 et 2a1 sont occupées ; l’OM 3a1 ne joue donc aucun rôle dans l’analyse du transfert d’électrons entre Cl- et le fragment métallique.
L’OM 1a1 décrit l’interaction de donation telle qu’elle a été vue dans les exemples précédents : deux électrons localisés dans une orbitale purement chlorure viennent occuper une OM en partie délocalisée sur le métal.
L’orbitale 2a1 décrit une densité de charge essentiellement localisée sur le chlorure et, de plus, à l’extérieur du segment M-Cl. Elle ne décrit donc pas une nouvelle donation du chlorure vers le métal mais une paire libre sur le chlorure. La prise en compte de l’OA 3s sur le chlore conduit toujours à diagramme de ce type où l’OM intermédiaire représente une paire libre sur le chlore.
En résumé, l’OM 1a1 décrit la donation et l’OM 2a1 une paire libre du chlore. Si l’on tient compte de la double donation p du chlorure vers le métal (interaction des orbitales e représentées en rouge dans la Figure), le chlorure se comporte comme un ligand à six électrons et conserve une paire libre qui ne peut en aucun cas être transférée vers le métal.
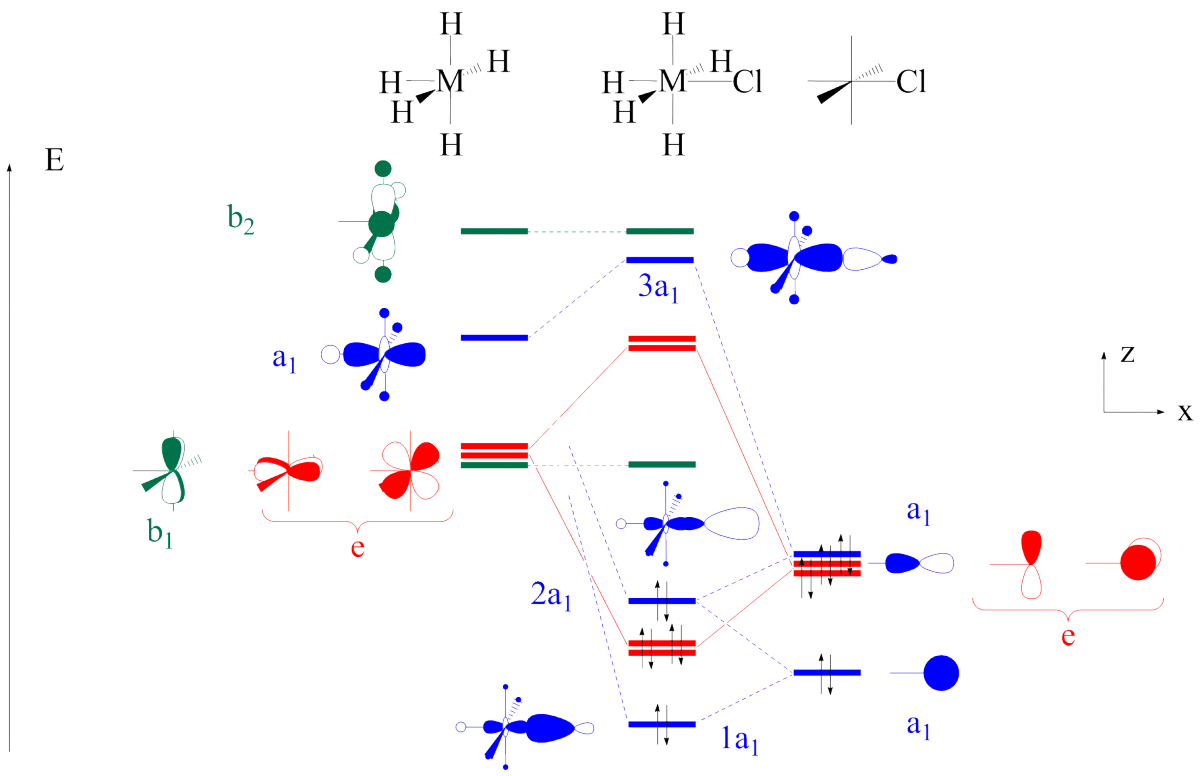
Figure 7. Diagramme d’interaction entre MH5(d0) et le ligand chlorure.
Une analyse similaire peut être effectuée sur les complexes octaédriques MCl6 de symétrie Oh. Dans l’exemple de CrCl6, le chrome possède six électrons de valence et le nombre total d’électrons est égal à Nt = 6 + 6*1 = 12 si l’on considère le chlore comme ligand X. On trouverait Nt = 24 ou 36 électrons en prenant le ligand Cl comme LX ou L2X. C’est à nouveau l’utilisation de la théorie des groupes qui permet d’établir un décompte électronique précis. Si l’on considère ce complexe comme résultant de l’interaction entre les fragments Cr6+ et (Cl-)6, on a pour le chrome dans le groupe Oh, les OA 4p qui sont une base de T1u, l’OA 4s une base de A1g et les OA 3d une base de (T2g ⨁ Eg).
Les RI des 18 OA 3p des ligands chlorure sont obtenues à l’aide d’une formule analogue à celle utilisée précédemment :
(A1g ⨁ T1u ⨁ Eg) ⨂ T1u = A1g ⨁ Eg ⨁ T1g ⨁ T2g ⨁ 2T1u ⨁ T2u
Chaque OA de Cr6+ trouve un partenaire du fragment (Cl-)6 pour interagir ; on a donc :
- deux électrons transférés vers le chrome via l’interaction des orbitales A1g ;
- quatre électrons transférés vers le chrome via l’interaction des orbitales Eg ;
- six électrons transférés vers le chrome via l’interaction des orbitales T2g ;
- six électrons transférés vers le chrome via l’interaction des orbitales T1u.
Formellement, CrCl6 est donc un complexe à 18 électrons. Parmi les 36 électrons disponibles dans les OA 3p du fragment (Cl-)6 , 18 sont transférés vers le métal comme on vient de le voir et 18 se trouvent dans des orbitales non liantes sur les chlorures : celles qui sont bases de T1g (6 électrons) de T1u (6 électrons) et de T2u (6 électrons). Les formes des OM non liantes t1g et t2u sont donnés ci-dessous2. Dans ce cas particulier, chaque ligand chlorure se comporte donc comme un ligand LX.