La notion de « vert » a fait l’objet de débats, certains y voyant une association directe aux plantes ou à la biomasse, d’autres le prenant pour un synonyme de « renouvelable ». Les piles à combustible sont considérées comme des alternatives renouvelables pour la production d’électricité, et au sein des biopiles à combustible la biomasse peut être utilisée à la fois pour fournir le combustible mais aussi le catalyseur qui est lui-même par nature renouvelable. Dans cet article, la notion de production verte d’électricité prend donc tout son sens et tous les sens.
Avant propos
Cet article fait suite à une journée organisée par la mission pour l’interdisciplinarité et l’Institut de Chimie du CNRS autour de la thématique « une chimie encore plus verte ». La notion de « vert » a fait l’objet de débats, certains y voyant une association directe aux plantes ou à la biomasse, d’autres le prenant pour un synonyme de « renouvelable ». Les piles à combustible sont considérées comme des alternatives renouvelables pour la production d’électricité, et au sein des biopiles à combustible la biomasse peut être utilisée à la fois pour fournir le combustible mais aussi le catalyseur qui est lui-même par nature renouvelable. Dans cet article, la notion de production verte d’électricité prend donc tout son sens et tous les sens.
Introduction
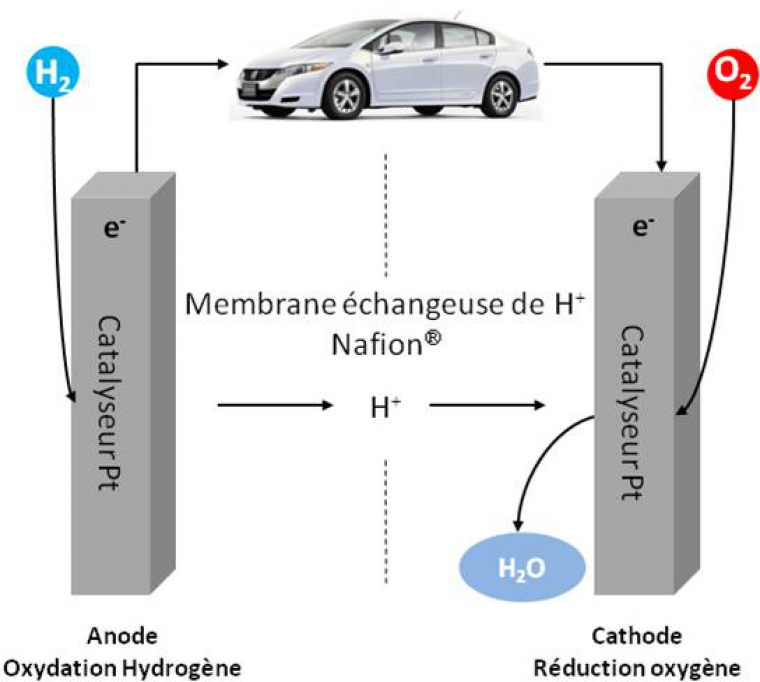
La réduction des émissions de gaz à effet de serre est un enjeu majeur pour limiter l’accroissement de la température sur une terre où la population mondiale augmente. Les citadins, en particulier, représentent aujourd’hui 54 % de la population totale et cette proportion atteindrait 70 % d’ici 15 ans. La demande énergétique va elle aussi croître, nous imposant des mutations profondes dans notre manière de produire et de consommer l’énergie. L’utilisation d’énergies renouvelables mais intermittentes, comme l’éolien ou le solaire, pose la problématique du stockage de l’électricité. L’hydrogène est une alternative intéressante qui permet à la fois le stockage puis la production d’électricité au sein de piles à combustible (Figure 1). Alternative d’ailleurs prédite par Jules Verne qui écrivait dès 1874 dans l’Ile Mystérieuse : « L’hydrogène et l’oxygène fourniront une source de chaleur et de lumière inépuisable, et l’eau décomposée en ses éléments constitutifs sans doute l’électricité ».
A l’anode, H2 est oxydé en protons ; les électrons circulent dans le circuit extérieur et les protons à travers une membrane séparatrice (polymère fluoré avec groupements sulfonates) vers la cathode où O2 est réduit en eau.
Dans une pile à combustible (PAC), l’énergie chimique contenue dans la réaction de combustion d’un combustible comme l’hydrogène va être transformée en énergie électrique, avec génération d’eau et de chaleur. Cette pile, contrairement aux piles alcalines par exemple, débitera tant qu’elle sera alimentée par de l’hydrogène et de l’oxygène. Le rendement électrique est, de plus, supérieur au rendement des moteurs thermiques, ce qui en fait un procédé prometteur pour des applications en transport. La gamme de puissance disponible, de 10 W à 1 MW, permet en outre d’autres applications, en particulier stationnaires.1
Que des avantages donc ! Alors pourquoi n’assistons nous pas au développement large échelle des PACs ?
Au-delà de considérations politiques et économiques, il y a plusieurs raisons technologiques à cela. Le premier verrou réside dans la nécessité de catalyser les réactions d’oxydation de l’hydrogène et de réduction de l’oxygène. Le meilleur catalyseur à ce jour est à base de platine. Même si les quantités de platine nécessaires sont en diminution, les faibles réserves de ce métal noble sur la planète en font un catalyseur très cher. Qui plus est, le platine est très facilement inhibé par des impuretés contenues dans l’hydrogène, comme le monoxyde de carbone (CO). Enfin, le platine n’est pas spécifique des réactions d’oxydation ou de réduction, ce qui impose une membrane séparatrice entre les compartiments anodiques et cathodiques. Cette membrane doit être une bonne conductrice de protons et représente non seulement un coût important mais aussi une limitation dans la géométrie de la pile.2
En conséquence, est-il possible de développer une PAC exempte de catalyseurs au platine ?
Des catalyseurs biologiques pour les piles à combustible
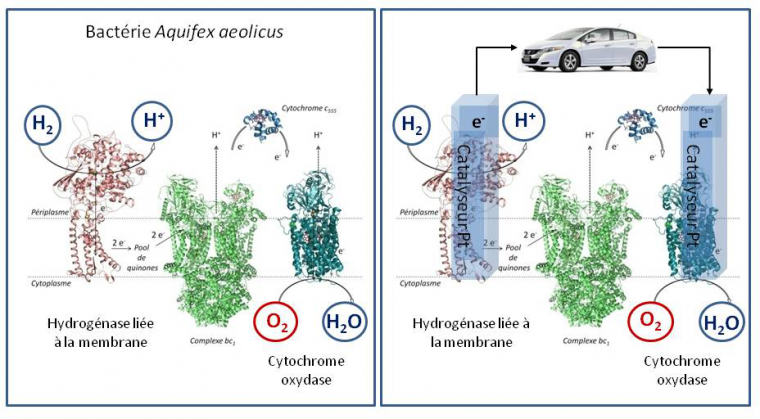
Le monde du vivant est source d’inspiration en la matière. Prenons l’exemple de la bactérie Aquifex aeolicus, bactérie ancestrale hyperthermophile (qui se développe à 85 °C), très intéressante car permettant non seulement d’étudier les bases moléculaires de résistance des microorganismes (ici l’apparition de l’oxygène sur terre) mais aussi d’identifier de nouvelles protéines et enzymes présentant des propriétés remarquables. Pour synthétiser l’adénosine triphosphate (ATP), la brique énergétique nécessaire aux réactions chimiques du métabolisme assurant la croissance des microorganismes, cette bactérie va coupler de part et d’autre de la membrane cellulaire l’oxydation de l’hydrogène à la réduction de l’oxygène (Figure 2).3
L’énergie issue de ce couplage électronique va être stockée sous forme d’un gradient de protons transmembranaire permettant d’actionner l’ATP synthase, enzyme qui permet la formation d’ATP.
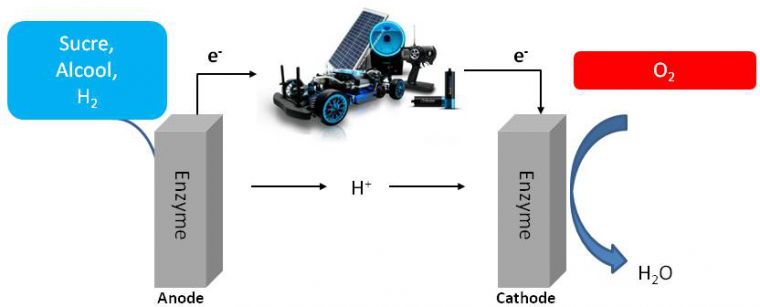
Cette chaine métabolique présente de fortes analogies avec une PAC. C’est ainsi que nait l’idée selon laquelle les enzymes impliquées, hydrogénase pour l’oxydation de l’hydrogène et cytochrome oxydase pour la réduction de l’oxygène, pourraient servir de catalyseurs dans un dispositif que l’on nommera biopile à combustible (BioPAC) (Figure 3). Comme il existe une grande variété de chaines de transport d’électrons dans les microorganismes, impliquant des substrats variés transformés par des enzymes spécifiques, le premier avantage de la BioPAC par rapport à la PAC chimique va être l’élargissement de la gamme des comburants (O2, H2O2) et combustibles (H2, sucres, alcools,…). Bien sûr pour obtenir une puissance de pile suffisante, il s’agira de choisir des couples redox permettant d’obtenir une force électromotrice la plus élevée possible. A ce titre, le couple combustible/comburant H2/O2 sera le plus énergétique.
On notera le changement d’échelle…les biopiles alimenteront plutôt de petits appareils stationnaires ou mobiles (ici une voiture télécommandée) que nos véhicules de transport.
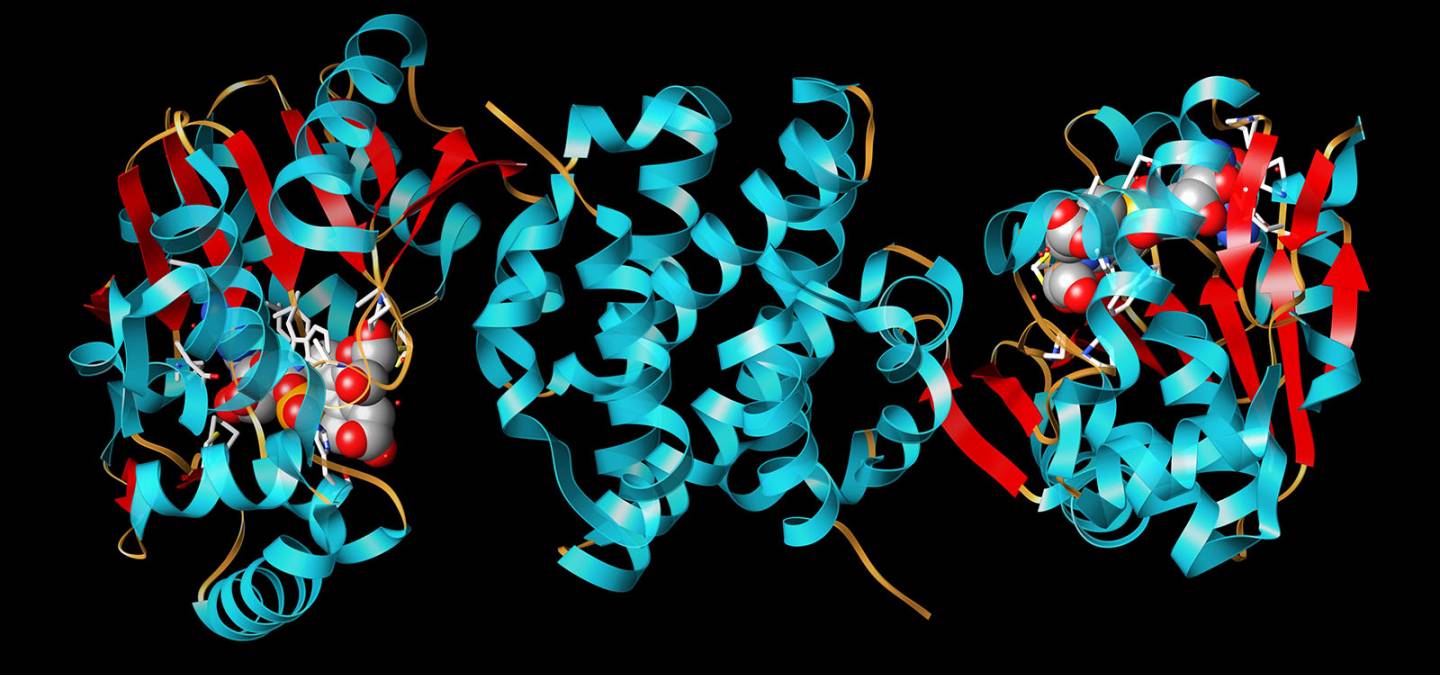
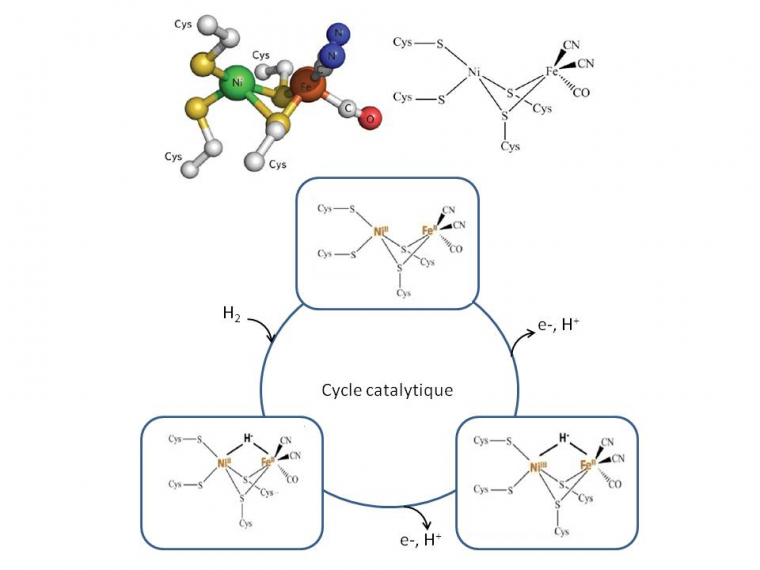
Les autres avantages viennent directement des propriétés intrinsèques des enzymes. Outre leur biodisponibilité et biodégradabilité, elles sont très efficaces pour la transformation des substrats qu’elles convertissent avec de faibles surtensions. Elles sont spécifiques pour la transformation d’un substrat donné, ce qui permet d’envisager la suppression de la membrane séparatrice, nécessaire dans une pile à combustible « classique ». Et finalement, en criblant la biodiversité, il est possible d’identifier des enzymes aux propriétés remarquables, comme la thermostabilité, la résistance aux pH extrêmes ou à certains inhibiteurs du platine comme le CO. C’est le cas de la bilirubin oxydase extraite de la bactérie Bacillus pumilus, protéine multicuivre qui réduit efficacement O2 en eau entre 30 et 70 °C.4 C’est aussi le cas de l’hydrogénase, enzyme clé de l’oxydation de H2, identifiée dans la bactérie ancestrale hyperthermophile Aquifex aeolicus, qui est complètement insensible au CO et oxyde H2 avec de forts rendements et sur une large gamme de température.5 Et ce sans aucun métal noble ! Le site actif où a lieu la réaction d’oxydation de H2 est en effet composé d’un atome de Ni et d’un atome de Fe, pontés par deux atomes de S de résidus aminés cystéine. L’atome de Ni est lui-même coordonné par les atomes de S de deux résidus cystéines du squelette protéique. Le Fe est lié à deux ligands cyanure et un groupement carbonyle. Lors de l’oxydation, le dihydrogène se fixe au site actif où il subit une coupure hétérolytique (ce mécanisme est différent de l’oxydation de H2 sur Pt, où la liaison H-H est coupée de façon homolytique pour former deux H adsorbés). L’hydrure formé ponte le Ni et le Fe, alors que H+ est lié au S d’une cystéine. Deux étapes monoélectroniques d’oxydation permettent ensuite la libération des deux protons (Figure 4).
Comment assurer la connexion électrique de ces objets supramoléculaires ?
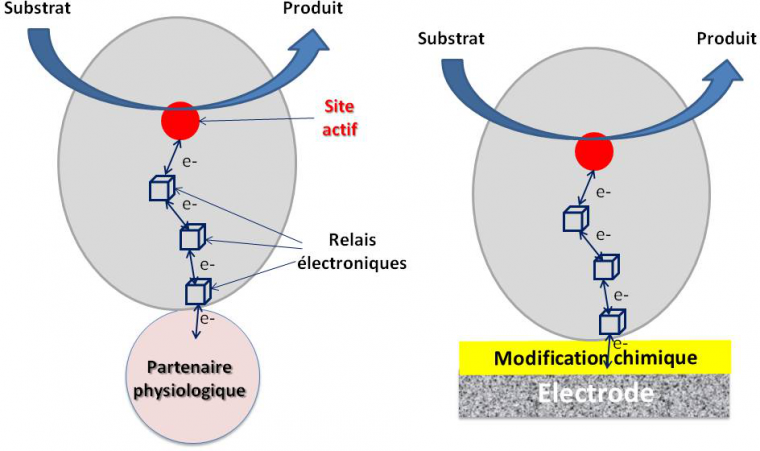
Les enzymes sont des objets de quelques nanomètres de diamètre. Les sites actifs, lieux de la transformation des substrats, sont souvent enfouis dans une structure protéique elle-même plutôt isolante. Reprenons l’exemple de l’hydrogénase d’A. aeolicus. Les électrons générés lors de l’oxydation du dihydrogène vont être transférés à travers la structure protéique jusqu’à la surface de la protéine le long de trois centres FeS. Ces relais électroniques constituent un véritable fil conducteur. In vivo, les électrons sont ensuite transférés au partenaire physiologique de la chaine de transfert d’électrons.
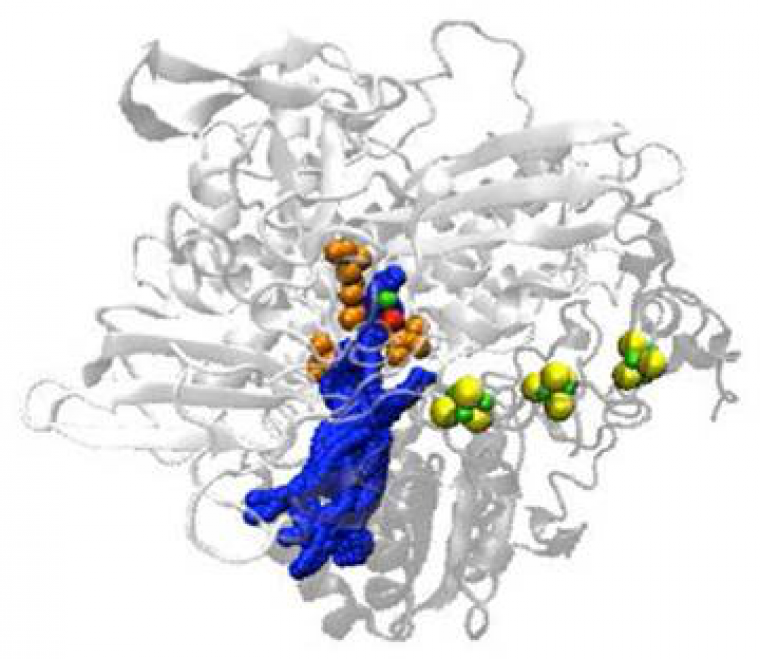
Pour assurer une catalyse enzymatique in vitro sur électrode, il faut d’abord que le substrat puisse accéder au site actif. Si l’on reprend l’exemple de l’hydrogénase d’Aquifex aeolicus, des modélisations en dynamique moléculaire ont permis de montrer que les canaux qu’emprunte H2 pour diffuser jusqu’au site actif sont tous situés du même côté de la protéine (Figure 5). Cette configuration des canaux, très certainement liée à la position membranaire de l’enzyme, impose de connaître les résidus acides aminés situés autour de l’embouchure du canal pour éviter la fixation de l’enzyme sur l’électrode via ces résidus.
Les boules vertes et jaunes représentent les trois clusters Fe-S, le site actif Ni-Fe apparait en rouge et vert, certains résidus acides aminés clés situés à l’embouchure du canal sont également pointés en orange.
Mais ce ne sera pas suffisant. Si l’on veut obtenir un transfert d’électrons efficace entre l’enzyme et l’électrode, il va falloir assurer une orientation de l’enzyme telle que le dernier relais électronique de surface se trouve à distance de l’ordre de 1,5 nm de l’interface électrochimique (Figure 6). Comment ? Simplement en mimant à l’électrode le site de reconnaissance entre l’enzyme et son partenaire. Cette reconnaissance peut se faire par fonctionnalisation chimique de l’interface électrochimique. Le pré requis est la connaissance de la structure cristallographique de l’enzyme et des résidus acides aminés dans l’environnement du relais électronique.
Ainsi, une orientation par simple interaction électrostatique entre l’enzyme et l’électrode est observée pour une hydrogénase bactérienne non membranaire (mais très sensible à O2 et au CO), ou encore pour une protéine multicuivre (bilirubin oxydase extraite de la bactérie Myrothecium verrucaria) qui réduit efficacement O2 en eau. Dans les deux cas, l’immobilisation orientée est liée à un fort moment dipolaire de l’enzyme, qui présente dans un environnement de moins de 15 Å du relais électronique de surface de nombreux résidus chargés négativement et positivement, respectivement. Dans le cas de l’hydrogénase tolérante à O2 et résistante au CO extraite d’Aquifex aeolicus, des analyses en dynamique moléculaire ont mis en évidence la faible valeur du moment dipolaire. Cette propriété est liée à la position membranaire de l’enzyme au sein d’Aquifex aeolicus, dont l’orientation in vivo est réalisée par l’ancrage à la membrane. Quelle que soit la charge de l’interface électrochimique, une distribution d’orientation de l’enzyme, et donc une distribution des constantes de vitesse pour la réaction catalytique, est obtenue. Une immobilisation par conséquent non optimale pour les performances de la future biopile.7
Des matrices tridimensionnelles pour lever la limitation liée à l’orientation de l’enzyme
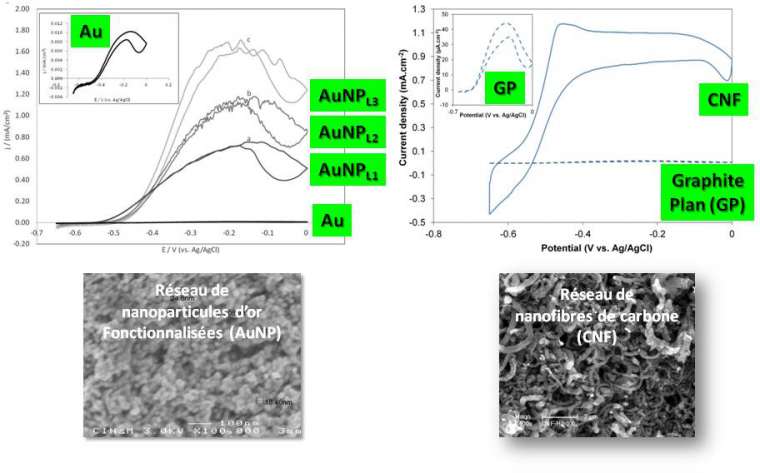
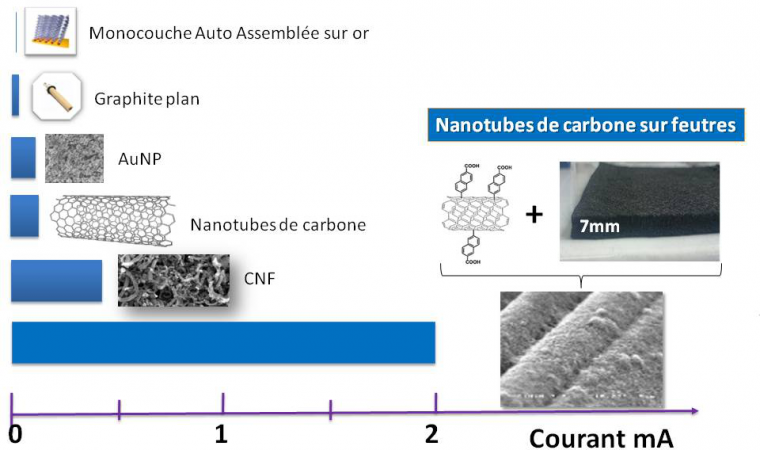
Peut-on dès lors lever cette limitation orientationnelle en incorporant l’enzyme dans des matrices conductrices 3D ? L’architecture augmentera la probabilité de connexion électrique tout en augmentant le nombre de sites d’interaction, donc la quantité d’enzymes disponible pour la catalyse, et in fine les courants de catalyse. Ce domaine de recherche est très prolifique : nanoparticules métalliques ou de carbone, nanotubes ou nanofibres de carbone, mésoporeux d’or… de nombreuses matrices ont prouvé leur efficacité pour l’incorporation efficace d’enzymes. A titre d’exemple, l’incorporation de l’hydrogénase d’Aquifex aeolicus sur des nanoparticules d’or de 20 nm de diamètre permet d’augmenter d’un facteur supérieur à 100 les courants d’oxydation enzymatique de H2. On peut montrer que cette augmentation est directement corrélée à l’augmentation de la surface électroactive consécutive aux dépôts successifs de nanoparticules.8 Des réseaux de nanofibres de carbone permettent eux aussi d’augmenter de façon significative les courants de catalyse, alors même que la nature plutôt hydrophobe de la surface n’est pas favorable à la connexion électrique de l’enzyme (Figure 7). Néanmoins la constante cinétique apparente de catalyse dans le réseau (50 s-1) est nettement inférieure à la constante attendue (> 1000 s-1), laissant supposer qu’une fraction importante d’enzymes est soit non connectée au réseau carboné, soit non active. De plus, l’augmentation de l’épaisseur de la matrice est responsable d’une faible stabilité mécanique de l’architecture 3D sur le collecteur de courant et d’une limitation par le transport de masse. L’efficacité enzymatique est telle que l’apport de substrat est rapidement limitant au sein de la matrice 3D.9
Le courant de catalyse mesuré par voltamétrie cyclique (réponse en courant à une rampe linéaire en potentiel) est une mesure de l’efficacité catalytique.
Pour résoudre ces limitations, il est possible de déposer les nanomatériaux sur des tissus de carbone de grande surface. L’idée est de fabriquer un matériau présentant des porosités hiérarchiques adaptées à la fois à l’immobilisation de l’enzyme et au transport du substrat et des produits de la réaction. De plus, sa structure va permettre de moduler facilement la géométrie, et de l’utiliser à la fois comme matrice d’incorporation de l’enzyme et comme collecteur de courant. C’est la piste suivie actuellement qui autorise déjà des augmentations de courant très conséquentes pour l’oxydation de H2 par l’hydrogénase d’Aquifex aeolicus (Figure 8).10
Quelques exemples de biopiles enzymatiques
La connaissance structurale des enzymes redox associée à la maîtrise de leur immobilisation fonctionnelle sur des interfaces électrochimiques, permet aujourd’hui le développement de biopiles enzymatiques dont les performances sont compatibles avec des applications. Deux types d’application sont visés : l’alimentation de dispositifs médicaux implantables et l’alimentation de dispositifs portables ou stationnaires à faible puissance.
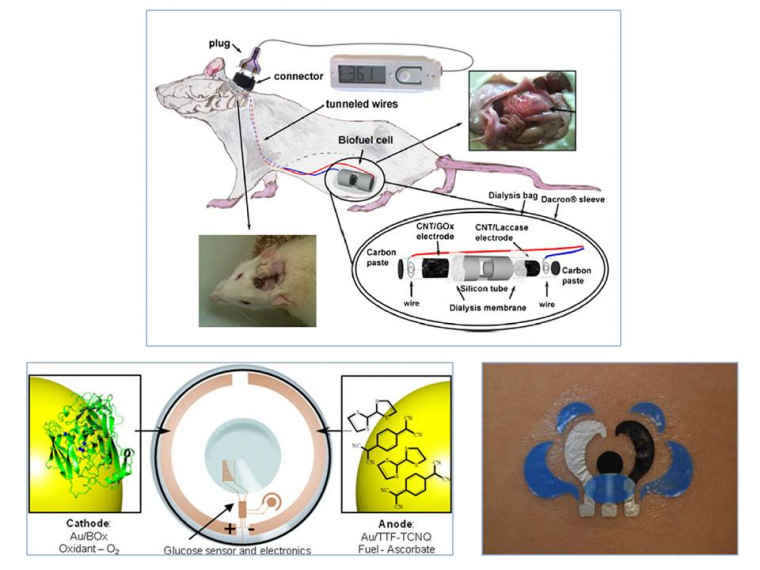
Utiliser l’énergie contenue dans les fluides physiologiques humains, glucose et oxygène, est bien sûr un concept particulièrement séduisant qui a justifié que la première application visée par les biopiles enzymatiques ait été l’alimentation de dispositifs médicaux implantés dans le corps humain (Figure 9). Dans ce cas, la glucose oxydase est le plus souvent utilisée pour oxyder le glucose - c’est aussi l’enzyme utilisée sur les bandelettes qui servent au dosage rapide du sucre dans le sang - tandis que des enzymes multi cuivre (type laccase ou bilirubine oxydase) réduisent O2 en eau. L’idée, à terme, serait d’alimenter un capteur au glucose par une biopile glucose/O2 implantée, et d’envoyer par radio les mesures en temps réel vers un patch délivrant l’insuline au patient diabétique en concentration voulue. Depuis la preuve de concept en 1964, puis l’implantation d’une biopile glucose/oxygène dans un grain de raisin en 2003, les recherches progressent rapidement grâce à des collaborations entre bioélectrochimistes et cliniciens. En 2010, un groupe français implantait un premier dispositif dans l’espace rétropéritonéal d’un rat. En 2013, le même groupe montrait que les améliorations apportées à la biopile en termes de matériaux d’électrode permettaient d’alimenter une LED et un thermomètre digital.11 Outre cette performance, certes encore modeste, cette étude a surtout permis de trouver les moyens de rendre biocompatible le dispositif complet. D’autres pistes sont actuellement poursuivies qui reposent sur l’utilisation de patchs à coller à même la peau, ou encore de lentilles de contact, tous deux équipés d’une biopile utilisant la sueur ou les larmes. Ces derniers dispositifs moins invasifs sont sans doute les procédés du futur.
En haut, une biopile glucose/O2 utilisant une glucose oxydase et une laccase, et implantée dans un rat alimente un thermomètre. En bas à gauche, une lentille de contact est équipée d’une biopile alimentant un capteur de glucose dans les larmes. En bas à droite, un tatoo est équipé d’une biopile lactate/O2.
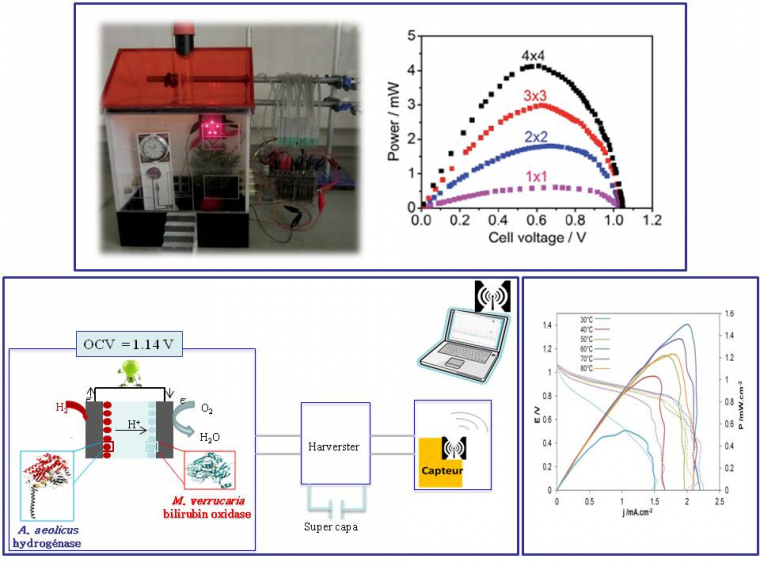
Bien sûr, utiliser l’hydrogène plutôt que le glucose à l’anode de la biopile doit permettre d’augmenter sa puissance. Cependant, jusque il y a une dizaine d’années, il était inimaginable de concevoir une biopile H2/O2 tant les hydrogénases étaient sensibles à l’oxygène. L’identification d’hydrogénases tolérantes à O2 et résistantes au CO, puis la compréhension des bases moléculaires expliquant ces résistances, ont permis d’envisager une nouvelle génération de biopiles.15 Ces dispositifs ont très vite progressé, car bénéficiant de recherches fondamentales pluridisciplinaires à la fois sur l’enzyme elle-même, les mécanismes catalytiques et les modes d’immobilisation (Figure 10). En 2010, la preuve de concept était publiée par une équipe d’Oxford, rapidement suivie en 2012 par les premières biopiles H2/O2 en France et en Angleterre, biopiles développant déjà des densités de puissance supérieures à celles développées par les biopiles glucose/O2. Les applications visées sont plutôt dans le domaine des capteurs environnementaux. En augmentant les surfaces développées et en travaillant sur l’électronique du système, notre laboratoire a en particulier montré en 2015 qu’une seule biopile H2/O2 suffisait à alimenter un circuit complet permettant l’envoi par radio de 5 mesures différentes toutes les 20 s.16 Nous avons par ailleurs joué avec la biodiversité pour utiliser des enzymes thermostables à l’anode et à la cathode. C’est ainsi qu’une biopile fonctionnant sur une gamme de température allant de 30 à 80 °C a été développée.7 Une plage de température jamais atteinte avec des enzymes extraites de microorganismes classiques, qui ouvre de nouvelles perspectives pour les biopiles !
En haut la biopile est basée sur l’hydrogénase O2-tolérante et mésophile extraite de la bactérie Escherichia coli à l’anode et de la bilirubine oxydase de Myrothecium verrucaria à la cathode.18 Les enzymes sont immobilisées sur des électrodes constituées de graphite et nanotubes de carbone compactées. Deux piles en série constituées chacune de 4 biopiles en parallèle permettent d’alimenter 5 LEDs rouges pendant 8h sans diminution de l’intensité lumineuse. En bas à gauche, la biopile est basée sur l’hydrogénase O2-tolérante et thermostable extraite de la bactérie A. aeolicus à l’anode et de la bilirubine oxydase de M. verrucaria à la cathode.19 Les deux enzymes sont immobilisées sur des électrodes constituées de feutre de carbone de grande surface (1 cm2) fonctionnalisés par des nanotubes de carbone. Une seule pile alimente un système électronique complet qui permet l’envoi de 5 mesures différentes par radio toutes les 20 s pendant 7 h. En bas à droite, la biopile est basée sur deux enzymes thermostables (hydrogénase de A. aeolicus à l’anode et bilirubine oxydase de Bacillus pumilus à la cathode).20 Les enzymes sont immobilisées sur des électrodes constituées de nanofibres de carbone. La pile présente une fem de 1,14 V (Open Circuit Voltage en anglais) et fonctionne sur une plage de température allant de 30 °C à 80 °C et délivre 1,5 mW/cm2 à 60 °C.
A quand la commercialisation des biopiles enzymatiques ?
Au-delà du coût des enzymes (qui devrait diminuer avec le développement des bioprocédés à large échelle), le plus grand obstacle à franchir est sans doute la stabilité des électrodes enzymatiques, même si l’on envisage des applications à courte durée, voire jetables. Cette instabilité a diverses origines qu’il s’agit de discriminer : instabilité intrinsèque liée à l’enzyme, instabilité liée à la conformation de l’enzyme une fois immobilisée, éventuellement instabilité liée au champ électrique, instabilité du biohybride enzyme/nanomatériaux/collecteur de courant. Des couplages de méthodes, en particulier spectroscopies de surface et électrochimie devraient permettre de comprendre les bases moléculaires de ces instabilités et d’y remédier.
Ces recherches sur les biopiles enzymatiques, au-delà du procédé innovant lui-même, permettent on le voit des avancées fondamentales quant au fonctionnement des enzymes immobilisées qui devrait trouver un écho dans les domaines des bioréacteurs ou des biocapteurs. Elles sont aussi à l’origine de la synthèse de complexes biomimétiques qui pourraient pallier la stabilité des bioélectrodes. Enfin les avancées dans le domaine des consortia bactériens laissent à imaginer la production d’hydrogène directement à partir de la biomasse pour alimenter la biopile H2/O2. En somme, une biopile complètement verte !
Glossaire
- Périplasme : Chez les bactéries, le périplasme désigne l'espace situé entre les deux barrières perméables sélectives que sont la membrane cytoplasmique (ou membrane interne) et la membrane externe.
- Bactéries hyperthermophiles : bactéries dont le développement est optimal à des températures supérieures à 80 °C
- Bactéries mésophiles : bactéries vivant à des températures comprises entre 20 et 40 °C
L’auteur tient à remercier tous les chercheurs du BIP qui ont contribué à ce travail, et particulièrement Alexandre Ciaccafava, Anne de Poulpiquet et Karen Monsalve, les doctorants qui ont permis le développement de la biopile H2/O2.
Références
- http://www.paristechreview.com/2015/03/23/hydrogene-pile-combustible
- S. Peighhambardoust et al., Int. J. Hydrogen Eng. (2010).
- M. Guiral et al., Adv. Microbial. Physiol. (2012).
- F. Durand et al., Biosensor Bioelec. (2012).
- X. Luo et al., J. Biol. Inorg. Chem. (2009).
- F. Oteri et al ., J. Phys. C hem. B (2014).
- A. Ciaccafava et al., Int. Ed. Angew. Chem. (2012) ; F. Oteri et al. Phys. Chem. Chem. Phys (2014).
- K. Monsalve et al., Bioelectrochem. (2015).
- A. de Poulpiquet et al., Phys. Chem. Chem. Phys. (2014).
- K. Monsalve et al., Electrochem. Commun. (2015).
- S. Cosnier et al., Electrochem. Commun. (2014).
- S. Cosnier et al., Electrochem. Commun. (2014).
- http://www.rsc.org/chemistryworld/2013/06/glucose-sensing-contact-lens-power-tears
- http://www.rsc.org/chemistryworld/2013/06/biofuel-cell-tattoo-sweat-health
- A. de Poulpiquet et al., ChemElectroChem (2014).
- K. Monsalve et al., Electrochem. Commun. (2015).
- A. de Poulpiquet et al., Electrochem. Commun. (2014).
- Xu et al., RSC Adv. (2015).
- K. Monsalve et al., Electrochem. Commun. (2015).
- A. de Poulpiquet et al., Electrochem. Commun. (2014).
- S. Benomar et al., Nat. Commun. (2015).