La cyclodextrine permet de solubiliser de nombreux composés hydrophobes dans l’eau grâce à sa cavité structurale. Elle est utilisée dans divers domaines comme la pharmaceutique, la dépollution de l’eau ou de l’air, la cosmétique ou l'agroalimentaire...
Un peu d'histoire
La cyclodextrine a été fabriqué pour la première fois par erreur en 1891 par Villiers. Celui-ci désirait réduire des dextrines grâce au bacillus amylobacter. Il découvrit, qu’en plus du produit qu’il voulait obtenir, quelques beaux cristaux se formaient. Après les avoirs analysés, Villiers découvrit que ce cristal était composé de plusieurs unités (C6H10O3).3H2O et l’appela « cellulosine ». Apparemment, sa formation était due à l’impureté des cultures utilisées par Villiers qui devaient contenir des traces de bacillus macerans.
Au début du XXème siècle, Schardinger réussit à isoler plusieurs cyclodextrines mais n’en connaissait pas la structure. Il fallut attendre l’apparition des analyses au rayon X pour qu’en 1948 la structure macrocyclique des cyclodextrines soit déterminée.
Structure des cyclodextrines
Les cyclodextrines forment une famille de macromolécules composées de 6 à 12 unités de D-glucose liées par liaison entre le carbone en position 4 d’une unité et le carbone en position 1 d’une autre comme présenté sur le schéma suivant (figure 1) :
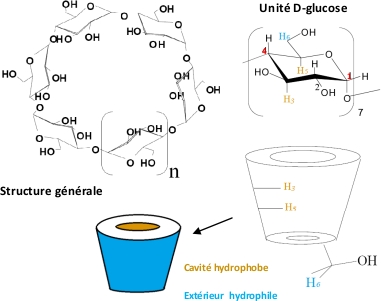
Figure 1. Structure des cyclodextrines.
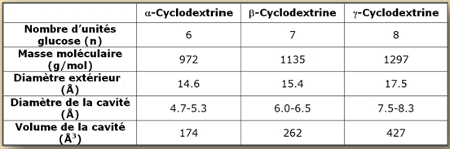
Les propriétés des cyclodextrines les plus courantes sont détaillées dans le tableau suivant :
Elles sont formées par dégradation enzymatique de l’amidon. Les unités de D-glucose forment un macrocycle. On peut le représenter sous la forme d’un cylindre creux.
Les groupements hydroxyle (hydrophile) sont situés vers l’extérieur et les hydrogènes (hydrophobe) sont orientés vers l’intérieur de la cavité donnant ainsi à la cyclodextrine la propriété d’être soluble dans l’eau et de pouvoir contenir des molécules hydrophobes.
Propriétés hydrosolubilisantes des cyclodextrines
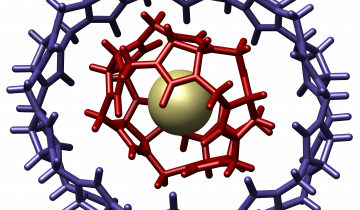
Certaines molécules ne sont pas solubles dans l’eau. Elles créent des répulsions avec l’eau et se retrouvent dans une autre phase (ex huile non soluble dans l’eau). Ces molécules sont miscibles à toutes les autres molécules hydrophobes, elles pourront donc se placer dans la cavité de la cyclodextrine (figure 2).
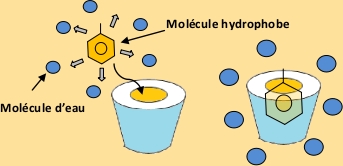
Figure 2. Cavité d'une cyclodextrine - effet d'encapsulation.
Les cyclodextrines étant hydrosolubles, les molécules hydrophobes peuvent ainsi être solubilisées dans l’eau. Le champ d'application des cyclodextines est donc vaste utilisant, entre autre, cette propriété de vecteur de molécule hydrophobe dans l'eau.
Les Applications
Les cosmétiques
En cosmétique, les cyclodextrines sont utilisées pour protéger les composés actifs de la chaleur, de la lumière, de l’oxydation, de l’hydrolyse, de l’évaporation ou de réactions avec d’autres composés du produit cosmétique.
La cosmétique employant beaucoup d’émulsion eau/huile, les cyclodextrines servent aussi à augmenter la solubilité des composés dans une crème à base d’eau et ainsi à stabiliser le produit (figure 3).

Figure 3. Les cyclodextrines aident à stabiliser les émulsions eau/huile des cosmétiques.
La pharmaceutique
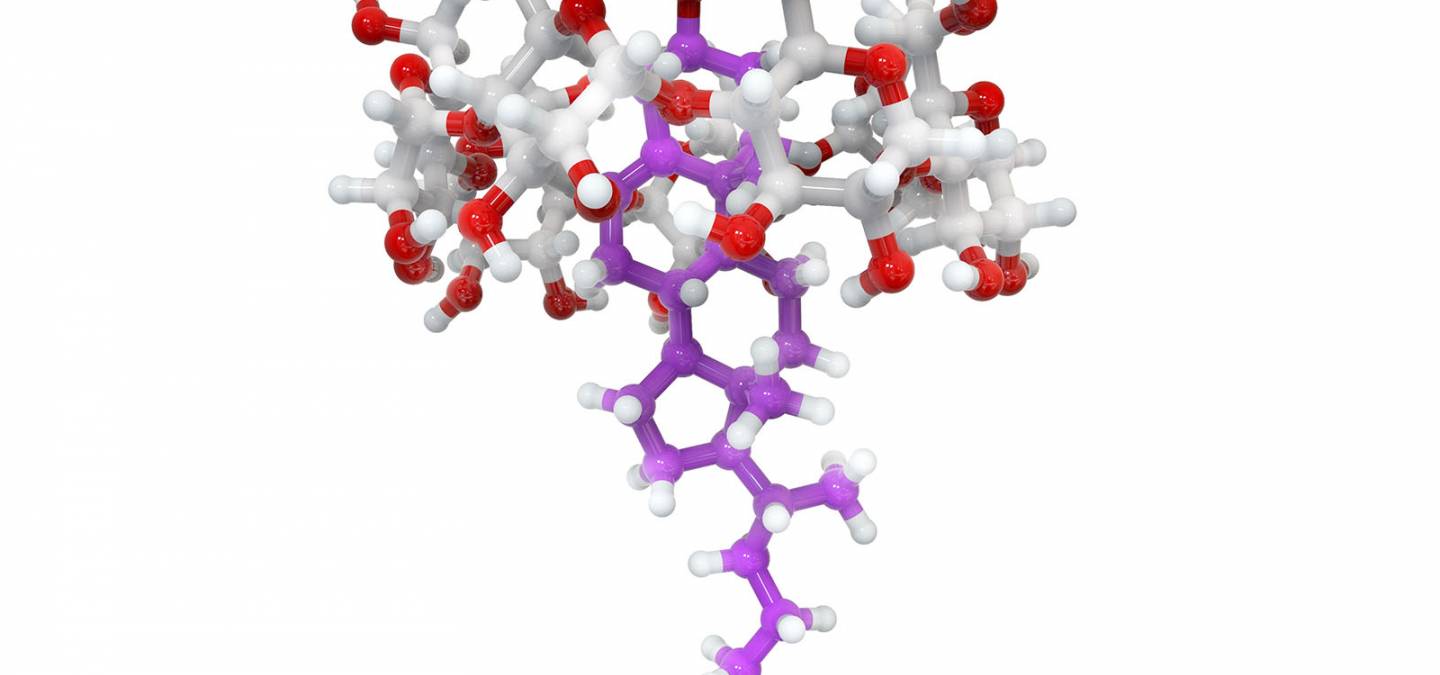
Le corps humain étant majoritairement composé d’eau, l’administration de médicaments hydrophobes devient problématique. Afin que la molécule thérapeutique atteigne la cible à soigner, elle peut être transportée dans l’organisme enfermée dans des cyclodextrines. Le médicament est ensuite délivré à la surface de la membrane des cellules infectées et la traverse car ils sont tous deux hydrophobes et donc miscibles.
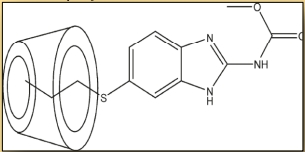
Figure 4. Agent anti-cancer ABZ complexé à une bêta-cyclodextrine.
Très récemment, cette technique a été utilisée pour l’administration de médicaments contre le cancer (figure 4).
La dépollution de l'eau et de l'air
Les cyclodextrines sont couramment utilisées pour le traitement de l’eau. Elles retiennent beaucoup de pesticides, d’insecticides, de métaux ou de composés organiques toxiques comme des phénols purifiant ainsi l’eau courante.
Elles décontaminent également l’air de composés volatils toxiques voir même cancérigènes comme les PAHs (Polycyclic Aromatic Hydrocarbon).
L'agroalimentaire
Les cyclodextrines peuvent être ingérées par l’homme, elles sont digérées en étant décomposées en D-glucose qui est assimilé par le corps comme un sucre. Elles sont considérées comme des additifs alimentaires et leurs conditions d’utilisations sont réglementées. Elles possèdent donc leur numéro SIN :
- α-cyclodextrine : E457
- β-cyclodextrine : E459
- γ-cyclodextrine : E458
La β-cyclodextrines est utilisée en agroalimentaire pour retirer le cholestérol du beurre, du lait ou des œufs. L’α-cyclodextrine sert, entre autres, à stabiliser les émulsions comme la crème, la mayonnaise ou la margarine.
Les cyclodextrines sont aussi utilisées pour « encapsuler » des arômes. En effet celles-ci ont une grande affinité avec les composés organiques volatils qui constituent souvent les arômes tels que le benzaldéhyde qui possède un goût et une odeur d’amande.

Figure 5. L'arôme de l'amande encapsulé par les cyclodextrines dans l'agroalimentaire ?
Retenir ainsi ces molécules « aromatiques » est utile lors de stockage long ou de procédé de fabrication lourd : le produit garde toute sa qualité organoleptique.
Conclusion
La cyclodextrine permet de solubiliser de nombreux composés hydrophobes dans l’eau grâce à sa cavité structurale. Elle est utilisée dans divers domaines comme la pharmaceutique, la dépollution de l’eau ou de l’air, la cosmétique ou l'agroalimentaire.
Son utilisation est tout de même limitée par le volume de sa cavité hydrophobe, toutes les molécules hydrophobes n’ont pas la bonne taille pour y rentrer ou y rester.
Enfin, concernant son utilisation dans l'alimentaire, sa toxicité n’est pas remise en cause mais sa pureté doit être très grande. En effet, les solvants, catalyseurs et sous produits de sa fabrication peuvent être nocifs pour la santé. C’est la principale raison pour laquelle son utilisation en tant qu’additif alimentaire peut être controversée.
Bibliographie
[1] E.M. Martin Del Valle, Cyclodextrins and their uses: a review, Process Biochemistry 2004, 39, 1033-1046.
[2] Hans-Jürgen Buchmann and Eckhard Schollmeyer, Applications of cyclodextrins in cosmetic products: A review, J. Cosmet. Sci. 2002, 53, 185-191.
[3] T. Vandamme, D. Poncelet, P. Subra-Paternault, Microencapsulation, Ed. TEC&DOC, Lavoisier, 2007, p. 280.
[4] Andrée Voilley et Patrick Etiévant, Flavour in food, CRC Press, Woodhead publishing limited, 2006, p.218-19, 223.