Cet article est le premier d'un dossier présentant le développement chimique, branche de l'industrie pharmaceutique qui participe au développement de la synthèse des principes actifs des médicaments et produit les lots nécessaires aux études cliniques avant commercialisation.
Ce premier article sur le développement chimique (ci-dessous) rappelle les différentes phases de la « vie » d'un médicament, de la découverte du principe actif à la commercialisation.
Le deuxième article décrit les missions des équipes travaillant au développement chimique.
Le troisième article traite du scale-up, autrement dit la transposition à grande échelle d'une synthèse élaborée en laboratoire.
Un glossaire, commun aux trois articles, est accessible à la fin de chaque article.
Introduction
Développer des médicaments innovants et s’engager dans le progrès thérapeutique au service des patients est une vocation. Derrière ce mot « médicament » se trouve un travail considérable de recherche et de développement. La plupart des chimistes en formation pensent à la chimie médicinale lorsque l’on parle d’entreprises pharmaceutiques ! Vous connaissez peut être le terme anglais de « Process R&D », qui regroupe l’ensemble des métiers de la recherche et du développement incluant la Chimie Organique et le Génie Chimique. Le développement chimique est la branche chimie dans le « Process R&D » ; il participe au développement de la synthèse des principes actifs (PA)1 des médicaments et produit les lots nécessaires aux études cliniques2 avant commercialisation. Qui sont ces personnes travaillant au développement chimique ? Aujourd’hui, ce sont des techniciens, associés généralement à des docteurs en chimie organique. Pourquoi ce métier existe-t-il ? C’est une nécessité, le PA d’un médicament doit être fabriqué à l’échelle de la tonne, de façon sûre, rentable et respectueuse de l’environnement.
Paradoxalement, ce métier passionnant est peu connu du grand public. Cet article présente ce métier et donne une image de son quotidien, selon deux aspects : les missions du développement chimique et les problématiques liées à la montée en échelle (le scale-up).
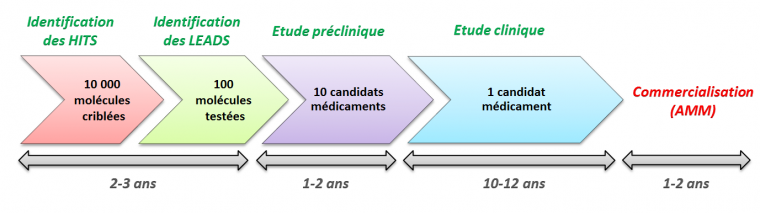
Précisons, avant d’entrer dans le vif du sujet, ce qui anime la « vie » d’un médicament. Loin d’être un long fleuve tranquille, ce processus est difficile et peu de molécules décrochent le graal d’une autorisation de mise sur le marché (AMM)3 pour la commercialisation (Figure 1).
La découverte d’un médicament
Un médicament, selon la définition du dictionnaire, est une « substance ou préparation administrée en vue d'établir un diagnostic médical, de traiter ou de prévenir une maladie, ou de restaurer, corriger, modifier des fonctions organiques ». Dans notre cas, un médicament, c’est un principe actif (PA), formulé avec des excipients4 (sucre, arôme ou autres), employé pour combattre une maladie.
L’un des défis de l’industrie pharmaceutique est donc de trouver de nouveaux PA et de nouvelles cibles thérapeutiques5 pour le traitement de nombreuses maladies. Ce travail de découverte est porté entre autres par la chimie médicinale, une discipline à l’interface de la chimie organique, la biochimie, l’informatique chimique et la pharmacologie.
Concrètement, pour découvrir un futur PA, les chimistes médicinaux doivent dans un premier temps identifier une cible thérapeutique, le plus souvent une protéine (par exemple une enzyme) ou un récepteur, cible qui est impliquée dans la pathologie visée. Ils testent ensuite de grandes librairies de molécules6 sur cette cible afin de déterminer des classes de composés actifs on parle alors de « hits ». Afin d’accélérer le processus de découverte de ces « hits », le criblage moléculaire est dorénavant remplacé par des tests in silico où la cible et les molécules actives sont modélisées informatiquement.
S’ensuit une phase d’optimisation qui consiste à modifier les « hits » pour améliorer leurs propriétés biologiques. Un effort considérable est demandé aux chimistes pour synthétiser rapidement les centaines de molécules nécessaires à cette phase. Bien entendu, cette recherche n’est pas qu’empirique et ces chercheurs médicinaux s’appuient sur la relation structure-activité (en anglais Quantitative Structure Activity Relationship, abrégé en QSAR) pour déterminer les pharmacophores, c’est-à-dire les parties de molécules qui confèrent de l’activité à un composé. Petit à petit, les structures se précisent et aboutissent après 3 ans d’études aux « leads », autrement dit les molécules les plus actives et les plus sélectives vis-à-vis de la cible thérapeutique, avec une toxicité moindre.
Il reste encore la phase de développement des candidats médicaments avec les différentes phases cliniques qui auront elles aussi leur lot d’échecs. Ainsi, pour plus de 10 000 molécules criblées aux prémices du projet, seule 1 obtiendra une quinzaine d’années plus tard une AMM et deviendra un médicament.
Le développement d’un médicament
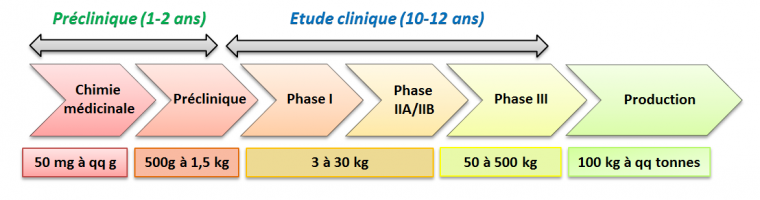
Après la découverte des « leads » vient une nouvelle étape dans laquelle il faudra produire les composés pour les études précliniques et cliniques. Ce processus, appelé développement du médicament, dure une douzaine d’années et se structure autour des différentes phases représentées sur la Figure 2 :
- La phase préclinique, qui confirme l’activité de la molécule sur des modèles animaux. Cette phase permet également d’identifier les effets indésirables qui pourraient empêcher un produit de passer en phase clinique, où ces essais sont réalisés sur l’Homme.
- La phase clinique I, durant laquelle sont évaluées la tolérance et la pharmacocinétique1 du candidat médicament sur une petite population volontaire. Des doses uniques ou répétées leur sont administrées afin de déterminer la dose maximale administrable à l’Homme.
- La phase clinique II, qui détermine l’efficacité du produit chez une petite population malade. Dans un premier temps (phase IIA), l’objectif est d’évaluer l’efficacité du médicament vis-à-vis de la pathologie ciblée. Ensuite, la phase IIB permet de définir la dose optimale selon le compromis efficacité/sécurité tout en continuant à évaluer les effets indésirables.
- La phase clinique III, la plus longue, qui est réalisée sur une population malade importante (quelques milliers de personnes), sur plusieurs années, afin de bien déterminer le rapport bénéfice/risque du médicament et ainsi permettre de déposer une demande d'autorisation de mise sur le marché (AMM).
- La phase IV ou pharmacovigilance2, qui intervient après obtention de l’AMM et tout au long de la commercialisation du médicament. Elle permet de suivre l’efficacité, la tolérance3 du produit sur le long terme et de comparer le médicament à d’autres produits de référence.
Dans cette histoire, le nerf de la guerre pour développer un médicament est bien de disposer de suffisamment de produit pour les études précliniques et cliniques. Et plus le projet avance, plus les quantités nécessaires sont importantes ! Le défi pour l’industrie pharmaceutique est donc de mettre au point une synthèse qui permette de produire le candidat médicament à grande échelle. C’est là qu’intervient le développement chimique.