Le fer est le métal le plus abondant sur Terre, après l'aluminium ; c’est aussi le plus utilisé par les sociétés humaines, notamment sous forme d’aciers ou d’alliages. De par ses propriétés physico-chimiques qui découlent de ses états électroniques divers, l’élément fer connait un renouveau dans de nouvelles applications dans les domaines de l’énergie, des nanotechnologies et de la santé. Cet article évoque la synthèse organométallique utilisant le fer.
Synthèse organique et chimie verte
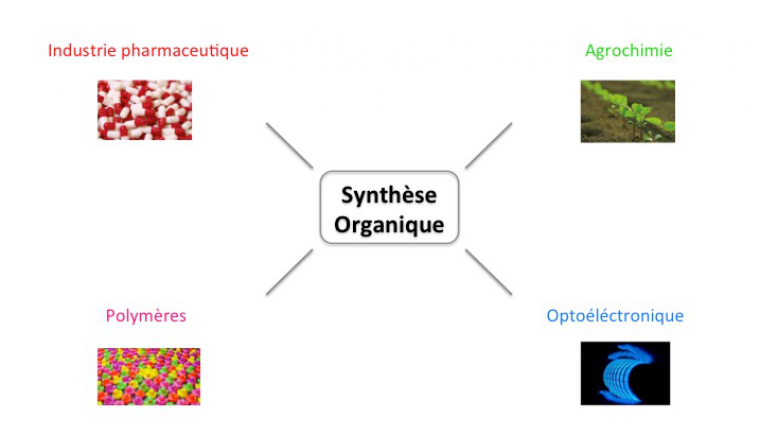
La synthèse organique est un élément « charnière » de la chimie car elle fournit des composés pour l’industrie pharmaceutique, l’optoélectronique, l’industrie des plastiques ou encore l’agriculture.
On peut décrire de façon imagée la synthèse d’une molécule comme l’agencement des groupes d’atomes les uns avec les autres, à la manière d’un jeu de construction type Lego® dans lequel il s’agit d’empiler des briques. La stratégie de synthèse consiste à déterminer les réactions qui permettent de lier les différentes « briques » les unes aux autres et l’ordre dans lequel réaliser ces réactions.
Depuis la fin des années 90, les principes de la chimie verte incitent les chimistes à envisager leurs synthèses en ne se focalisant plus seulement sur le rendement des différentes étapes mais en prenant en compte, entre autres, les critères suivants :
- la faible toxicité des réactifs et des produits, à la fois pour l’être humain et pour l’environnement ;
- la limitation des déchets produits par la synthèse : il vaut mieux essayer de réduire au maximum les déchets produits que d’investir dans le traitement de déchets ;
- l’économie d’atomes ;
- l’utilisation de ressources abondantes et si possible renouvelables ;
- le choix de réactions sélectives ;
- la catalyse : les réactifs catalytiques sont plus efficaces que les réactifs stœchiométriques. Il faut favoriser l'utilisation de réactifs catalytiques les plus sélectifs possibles.
L’élément fer est impliquées dans de nombreux types de réaction; cet article propose d'illustrer des réactions catalysées par le fer utilisant ses propriétés d’oxydoréduction (couplages organométalliques) et d'autres utilisant son acidité de Lewis (hétérocyclisations).
Couplages organométalliques utilisant le fer
Rappel sur les couplages organométalliques
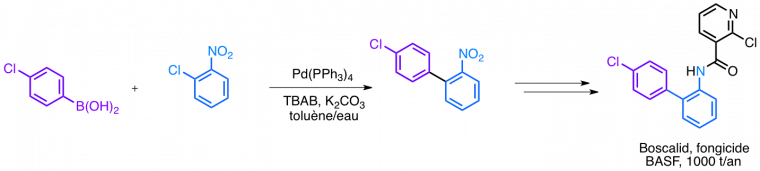
Les couplages croisés métallo-catalysés, développés dans les années 1980, sont des réactions incontournables de la chimie organométallique, mettant en jeu la création d’une liaison C-C et l’utilisation d’un catalyseur à base de palladium ou de nickel. On peut les schématiser par le bilan suivant:
Ils sont notamment utilisés dans l’industrie chimique : par exemple, la synthèse du fongicide appelé BOSCALID, commercialisé par BASF, utilise l’un de ces couplages.
Les travaux de Heck, Negishi et Suzuki dans le domaine des couplages croisés métallo-catalysés à base de palladium ont été récompensés par le prix Nobel de Chimie en 2010.
Nécessité d'une alternative
L’inconvénient majeur des couplages métallo-catalysés repose sur l’utilisation de métaux chers (palladium, nickel) et éventuellement peu abondants (palladium). La raréfaction des ressources de palladium dans le futur et la toxicité du nickel conduisent à chercher une alternative : le fer, bien moins cher, pourrait-il en constituer une ?
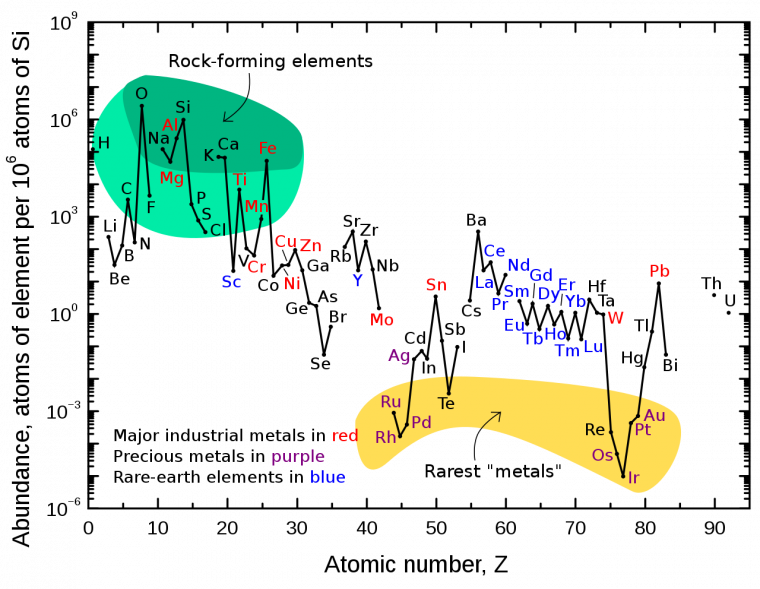
Le graphique ci-dessous représente l'abondance des éléments sur Terre en fonction de leur numéro atomique.
Sont représentés:
- en rouge : les principaux métaux utilisés dans l’industrie ;
- en vert : les métaux précieux ;
- en bleu : les terres rares ;
Dans la zone verte se situent les éléments présents dans les roches (la zone vert foncé regroupe les éléments les plus abondants et la zone vert clair les éléments les moins abondants).
Il apparaît donc clairement que le fer est un métal abondant, par ailleurs bien moins cher que le nickel et le palladium : ces deux atouts en font un métal de choix pour une catalyse respectant les principes de la chimie verte. Les complexes de fer étant en outre peu toxiques, on comprend l'intérêt de remplacer autant que possible les complexes de palladium et de nickel par des complexes de fer, dans les couplages croisés métallo-catalysés.
Historique des travaux de recherche sur les couplages à base de fer
Les couplages utilisant du fer ont été étudiés dès les années 1970. L’équipe de Kochi s’était par exemple intéressée aux couplages entre un organomagnésien et un halogénure de vinyle, catalysés par des complexes de fer. Les rendements de ces réactions étant faibles par rapport à ceux des couplages utilisant du palladium et du nickel, les travaux de recherche dans ce domaine ont été laissés à l’abandon jusqu’à la fin des années 1990.

L’équipe de Cahiez découvre à cette époque que l’ajout d’un additif comme la N-méthylpyrrolidone (NMP) dans le milieu réactionnel permet d’améliorer significativement le rendement.


Enfin, au début des années 2000, les travaux de l’équipe de Nakamura montrent qu’il est possible d’utiliser des halogénures d’alkyle au lieu d’halogénures de vinyle.


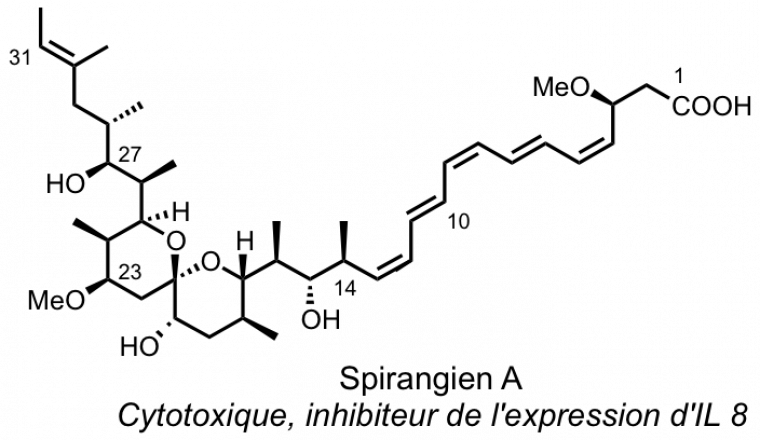
Synthèse du spirangien A
Le laboratoire de chimie organique de l'ESPCI s'est intéressé à la synthèse du spirangien A, composé cytotoxique produit par une myxobactérie appelée sorangium cellulosum.
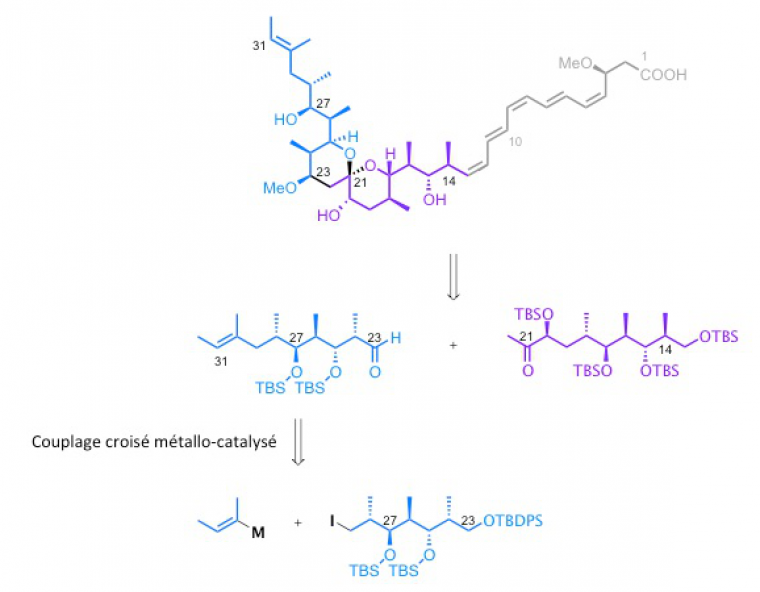
La stratégie de synthèse du spirangien A passe par la rétrosynthèse, processus mental dans lequel on découpe la molécule en différents synthons (différentes « briques ») et on propose des réactions liant ces différents synthons. En particulier, le synthon bleu peut être construit via un couplage croisé métallo-catalysé.
Remarque : on observe qu’au cours de la synthèse, les groupes –OH doivent être protégés sous la forme d’éthers de silyle de formule générale R1R2R3-O-R4, où R1, R2, R3 et R4 sont des groupes alkyles ou aryles (par exemple OTBS = éther de tert-butyldiméthylsilyle, c'est-à-dire que R1 et R2 sont des groupes méthyles et R3 est un groupe tertiobutyle).
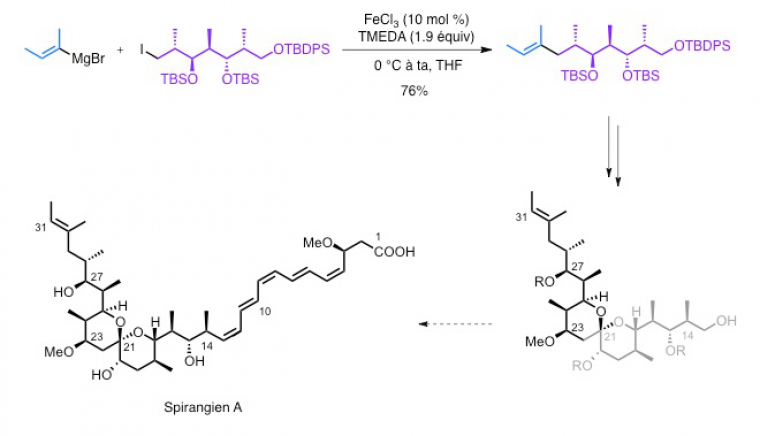
Les premiers essais de couplage croisé métallocatalysé utilisant des catalyseurs classiques ne conduisent pas au composé désiré. Le laboratoire s'est alors intéressé aux couplages croisés métallocatalysés utilisant le fer et a développé toute une méthodologie permettant de synthétiser un grand nombre de composés :

Exemples de composés obtenus :

Ces résultats sont tirés de la publication A. Guérinot, S. Reymond, J. Cossy, Angew. Chem. Int. Ed. 2007, 46, 6521.
Cette méthodologie a ensuite été appliquée à la synthèse du spirangien A : l’étape de couplage croisé métallo-catalysé s’est déroulée avec un bon rendement (76 %). D’autres étapes, non détaillées ici, ont ensuite conduit au spirangien A.
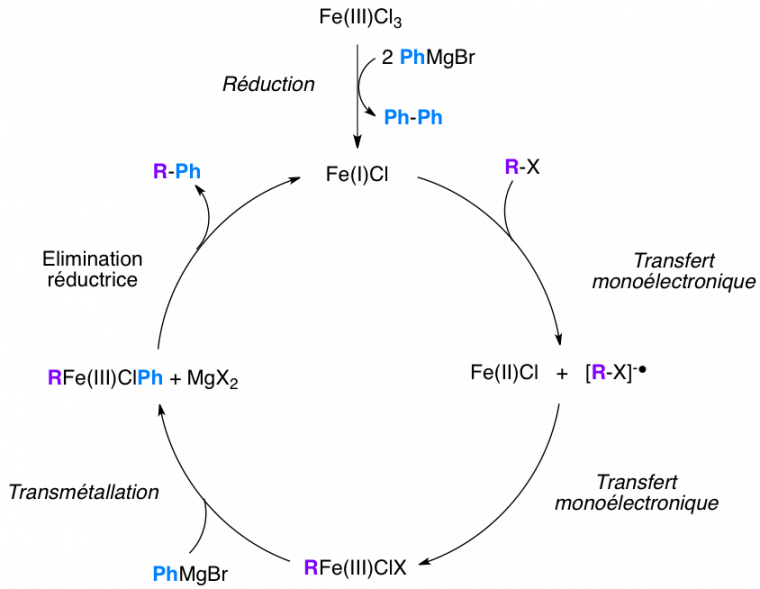
Un mécanisme simplifié à été proposé pour ce couplage
Il reste hypothétique pour l'instant, l'ordre des étapes élémentaires étant incertain et le rôle des ligands pas encore établi précisément.
Hétérocyclisations utilisant le fer
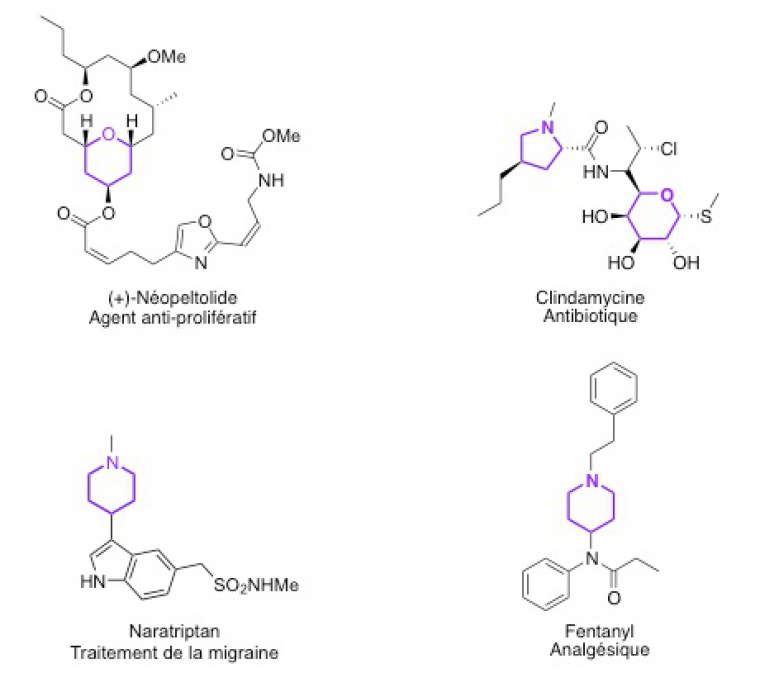
Les hétérocycles sont des composés comportant un cycle mettant en jeu au moins deux éléments différents, généralement l'élément carbone et un autre élément tel que l'oxygène, l'azote etc, qualifié d'hétéroélément. Ces hétérocycles sont très présents en chimie médicinale : on les rencontre dans un certain nombre de principes actifs.
La formation d’hétérocycles peut résulter de cyclisations métallo-catalysées. Celle présentée ci-dessous possède l’avantage de respecter des principes de la chimie verte comme l’économie d’atome, l’absence de déchets toxiques et la catalyse.

L'inconvénient réside dans le fait que les catalyseurs utilisés habituellement pour ce type de réaction sont à base de palladium, or et argent, métaux chers.
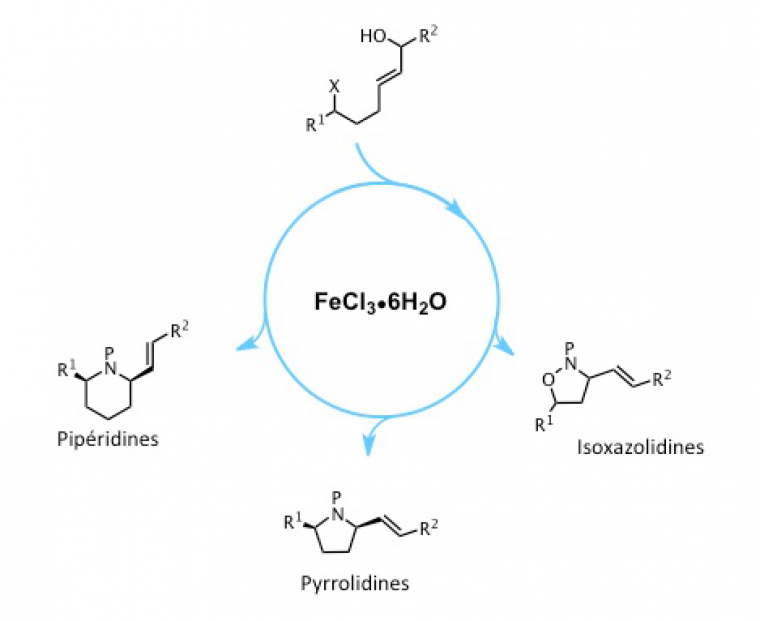
Une publication de 2008 a montré qu’il était possible d’activer un alcool par FeCl3 (via ses propriétés acides de Lewis) pour favoriser la formation du carbocation correspondant.

(source : Jana et al., Tetrahedron Lett. 2008, 858)
Le laboratoire a donc cherché à transposer ce résultat à la formation d’un hétérocycle passant par un carbocation, et ainsi à remplacer l’utilisation de métaux nobles par celle du fer. Plusieurs essais ont été réalisés pour cette hétérocyclisation, de façon à optimiser les conditions opératoires.

| Catalyseur | Temps | Rendement | Proportions cis/trans |
|---|---|---|---|
| FeCl3, 6 H2O | 2 h | 66 % | 97:3 |
| InCl3 | 48 h | 76 % | 92:8 |
| TiCl4 | 96 h | 96 % | 76:24 |
| HCl | 24 h | 0 % | - |
La réaction utilisant FeCl3, 6 H2O présente un rendement correct assorti d’un temps de réaction court et d’une très bonne diastéréosélectivité. Une étude cinétique de cette réaction a été menée.
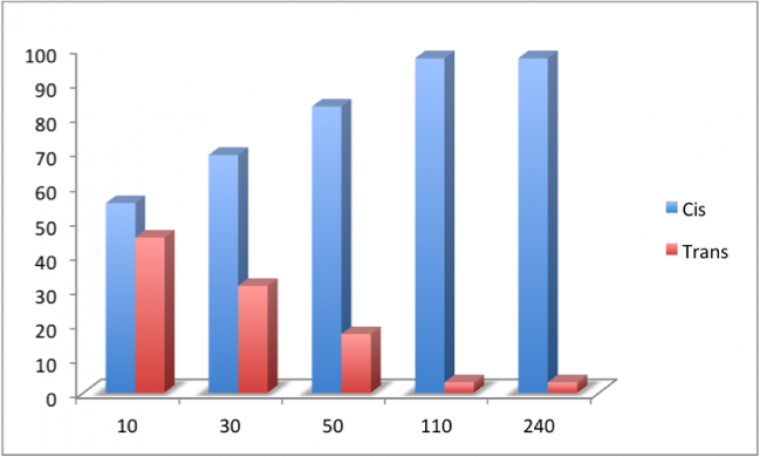
Le suivi cinétique de la réaction montre qu’en début de réaction, les diastéréoisomères cis et trans sont formés en proportions voisines. Ce n’est qu’au fur et à mesure que la sélectivité apparaît : au bout de 110 minutes environ, le mélange contient 97 % de composé cis et 3 % de composé trans.
On observe donc qu’en plaçant la réaction sous contrôle thermodynamique (durée de réaction suffisamment longue), le composé cis, plus stable que le composé trans, est obtenu majoritairement.
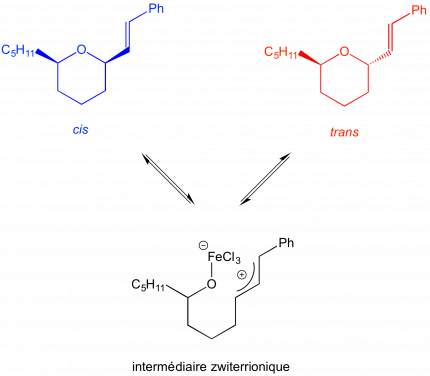
Le mécanisme met bien sûr en jeu l’acidité de Lewis du chlorure de fer (III) et passe par un intermédiaire zwiterrionique. L'équilibre chimique qui existe entre les composés cis, trans et l'intermédiaire zwiterrionique permet l'obtention, au bout d'un temps suffisamment long, du composé le plus stable, à savoir le composé cis.
L’optimisation des conditions opératoires réalisée sur la réaction précédente a permis de synthétiser un grand nombre de tétrahydropyranes, en collaboration avec la société JANSSEN. Les rendements obtenus sont très bons, de même que la diastéréosélectivité.


(sources : Cossy et al. Org. Lett. 2010, 12, 1808 ; Cossy et al. Tetrahedron 2011, 67, 5024)
La méthodologie développée a pu être appliquée à la synthèse d’autres hétérocycles comme des pipéridines, des isoxazolidines ou des pyrrolidines.
En conclusion, les résultats présentés dans cet article montrent que le fer permet de catalyser efficacement des réactions de couplage croisé et d'hétérocyclisation. Il s'avère, en outre, que le fer permet également de catalyser des oxydations et des hydrogénations, d'où un large panel de réactions possibles pour le chimiste, utilisant un métal abondant et peu cher. La catalyse à base de fer a de beaux jours devant elle !