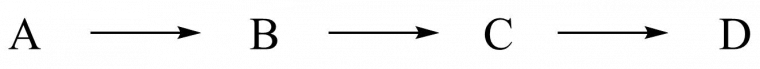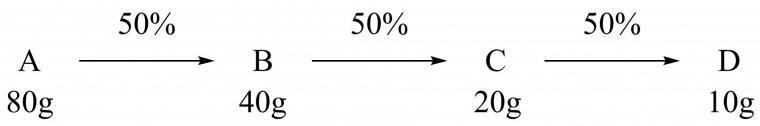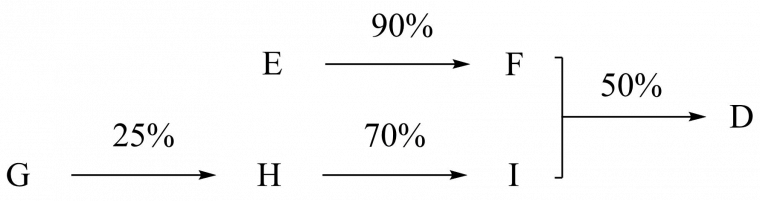Cet article présente les différentes voies utilisées pour la synthèse de principes actifs (synthèse linéaire, synthèse convergente, synthèse divergente) et le repositionnement d'un médicament, en prenant l'exemple du Sildenafil, principe actif du Viagra®.
Introduction
Lorsqu’un chimiste cherche à synthétiser un composé donné, une importante phase d’élaboration concernant la stratégie à adopter est nécessaire. Cela concerne aussi bien une extensive recherche bibliographique qu’une connaissance solide des réactions chimiques « usuelles ». Cette réflexion est souvent accompagnée d’une multitude d’astuces afin d’éviter que la synthèse n’ait un trop faible rendement, autrement dit que la stratégie adoptée soit peu efficace. Parmi ces points, savoir choisir entre une synthèse linéaire et une synthèse convergente est important suivant le composé à produire (nombre et type des groupements fonctionnels) et le mode de production (grande ou petite quantité).
Pour illustrer ces différentes stratégies de synthèse, j’ai choisi un exemple de chimie-médicinale historique : la synthèse du Sildenafil.
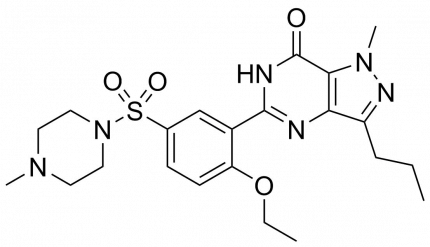
Le sildenafil est un inhibiteur d’enzyme phosphodiestérase-5 (PDE-5) sur le second messager nommé « guanosine monophosphate cyclique » dans les cellules de muscle lisse bordant les vaisseaux sanguins, les poumons et les plaquettes. Cette enzyme phosphodiestérase est, comme son nom l’indique, capable de briser les liaisons phosphodiester, ce qui lui donne un rôle privilégié d’agent activant de nombreuses molécules (et donc des mécanismes biologiques associés) dans le corps. Elle appartient en outre à une famille d’enzymes relativement vaste (12 enzymes, nommées de PDE-1 à PDE-12), dont les rôles sont extrêmement variés et localisés dans de nombreux types de cellules.
Une enzyme aussi importante a donc bien évidemment fait l’objet de nombreuses recherches afin d’en tirer un potentiel médicament capable d’agir sur son mode d’action et d’enrayer tout fonctionnement anormal, notamment un inhibiteur de cette enzyme, qui permettrait de bloquer son fonctionnement dans le cas où cette dernière deviendrait incontrôlable.
Développé par Pfizer durant les années 1990, le Sildenafil avait pour vocation de traiter divers troubles cardiovasculaires via une relaxation des vaisseaux sanguins par inhibition spécifique de la phosphodiestérase-5.
Ce composé a connu diverses voies de synthèse au cours de son histoire, qui nous permettront de nous attarder sur chacune des stratégies possibles :
- Synthèse linéaire historique développée dans les départements Recherche et Développement de Pfizer
- Synthèse convergente industrielle pour commercialisation
- Synthèse divergente par d’autres laboratoires pour développer des analogues (composés chimiques de structure proche mais non identique au modèle, ici la molécule de Sildenafil)
Stratégies de synthèse
Synthèse linéaire : définition et illustration
La synthèse linéaire est une stratégie de synthèse impliquant que chaque étape soit directement la suite de la précédente, sans aucun découpage ni aucun recoupement en différentes voies. Les réactions ne peuvent avoir lieu qu’en série, car il s’agit d’une suite de réactions continue (le composé C ne peut être obtenu que par transformation du composé B).
C’est une stratégie efficace dans le cas où la synthèse proposée comporte peu d’étapes. En effet, il peut arriver que certaines synthèses longues possèdent des rendements par étape plus élevés que le rendement des étapes d’une synthèse courte, ce qui tendrait à favoriser la synthèse longue. C’est malheureusement un effet trompeur, car plus le nombre d’étapes de synthèse augmente, plus le rendement final diminue ! Les synthèses courtes sont en général à favoriser en termes d’efficacité et de rendement.
Par exemple, avec une synthèse de 7 étapes à 80% de rendement chacune, nous obtenons comme rendement global :
$$\eta_{long}=0,80^7=21\%$$
Tandis que pour une synthèse de quatre étapes dont trois étapes donnent 80% de rendement et une étape 50%, nous obtenons :
$$\eta_{court}=0,80^3\times0,50=26\%$$
Il apparait alors clairement qu’il est préférable de choisir la synthèse la plus courte possible, quitte à privilégier une voie possédant une étape avec un rendement plus modeste.
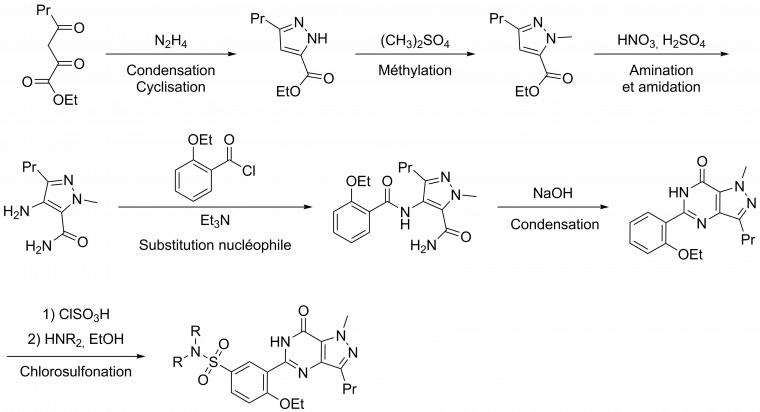
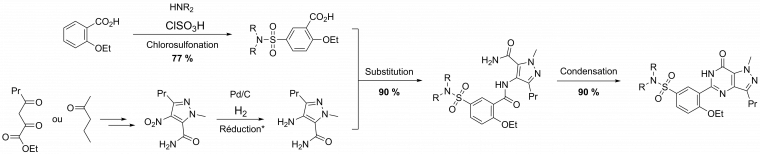
Dans le cas du Sildenafil, voici la synthèse linéaire (et historique) qui fut proposée :
Pr désigne le groupe propyle -CH2-CH2-CH3.
Note : ceci est une version simplifiée à visée d’exemple, se reporter aux publications originales [2, 3, 4] pour les conditions exactes. Les rendements ne sont malheureusement pas fournis dans la publication originale de cette synthèse [4].
Synthèse convergente : définition et illustration
En général, il est préférable (lorsque cela est possible) de privilégier une synthèse convergente, car cette stratégie implique la mise en commun de réactifs essentiels à la préparation du produit à une étape de la synthèse.
Dans le cas où le nombre total d’étapes de synthèse est identique entre les stratégies linéaire et convergente, la synthèse convergente doit être privilégiée. En effet, même si le nombre d’étapes est identique, cela permet d’effectuer les réactions en parallèle les unes des autres, et ainsi de progresser plus vite. De même, dans le cas d’un accident au cours d’une étape de synthèse, seule une branche de la stratégie se retrouve impactée, ce qui permet une meilleure distribution des risques qu’avec une synthèse linéaire. Cet aspect sécuritaire est loin d’être négligeable sur les synthèses à grande échelle, ce qui amène les industriels à préférer les synthèses convergentes.
Un autre avantage de la synthèse convergente vis-à-vis de la synthèse linéaire apparait lorsque l’on compare les quantités de réactifs impliqués pour chaque étape (on considérera dans cet exemple que les masses molaires des composés sont toutes identiques pour plus de simplicité) :
Il apparait clairement que les masses de matière première à engager sont moindres dans le cas d’une synthèse convergente, et ce pour un nombre d’étapes et des rendements identiques.
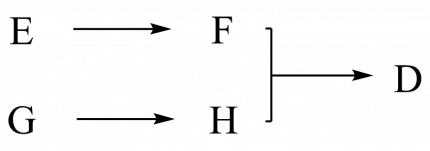
Cependant, un calcul de rendement global est loin d’être simple dans le cas d’une synthèse convergente, et reste souvent très approximatif. En effet pour le calculer, il est d’usage de multiplier les rendements des étapes de la suite réactionnelle la plus longue (G → H → I → D dans le schéma ci-dessous), en négligeant la suite la plus courte (E → F).
Dans ce cas, le rendement global menant au composé D sera :
$$\eta_{D}=0,25\times0,70\times0,50=9\%$$
Concernant le Sildenafil, c’est une stratégie de synthèse convergente qui permet sa production à l’échelle industrielle :
*produit brut utilisé sans purification supplémentaire, donc pas de rendement calculable possible, étant donné qu’il s’agit de la branche réactionnelle la plus longue.
Note : ceci est une version simplifiée à visée d’exemple, se reporter aux publications antérieures (références [3], [5] et [6]) pour les conditions exactes. Par ailleurs, les étapes menant à l’intermédiaire pyrazole (branche du bas sur la figure) sont identiques à celles présentées dans la figure 3.
Synthèse divergente : définition et illustration
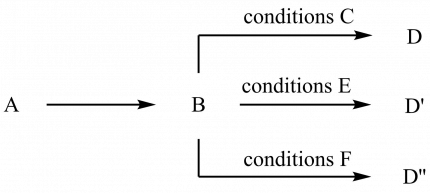
La synthèse divergente est une stratégie extrêmement commune dans tous les domaines de la chimie (plus particulièrement en chimie médicinale pour l’exemple qui nous intéresse), qui permet de générer un grand nombre d’analogues d’une molécule donnée à partir d’un intermédiaire commun.
Il s’agit alors de synthétiser cet intermédiaire commun (sur la figure 9, le composé B), si possible en grande quantité, puis de l’utiliser suivant différents mode opératoires (réactifs, conditions…) pour obtenir différentes « variations » autour d’un modèle de produit, généralement des analogues (substituants différents) ou des isomères (isomères de constitution ou stéréo-isomères).
Ainsi, cette stratégie est généralement utilisée en chimie médicinale dans le cadre de l’optimisation d’une « touche » (« hit » en anglais) pour produire des « têtes de série » (« lead » en anglais) ou encore pour améliorer la stabilité, la solubilité ou réduire la toxicité d’une « tête de série ». Pour plus de précisions concernant ces dénominations, voir l'article De la molécule au médicament, un parcours semé d'embûches.
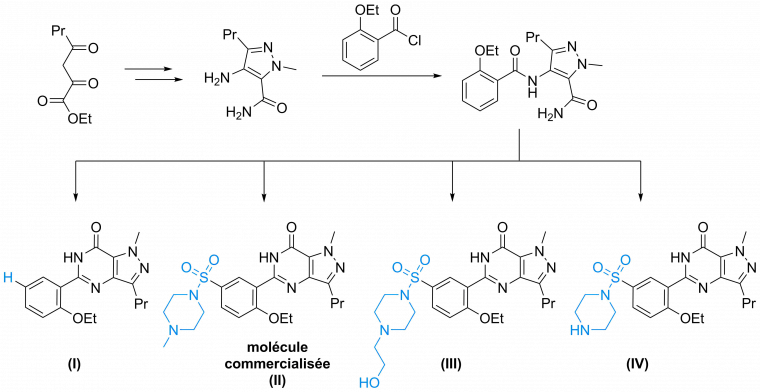
En ce qui concerne le Sildenafil, cette stratégie est par exemple décrite dans un brevet de Pfizer :
Note : ceci est une version simplifiée à visée d’exemple, se reporter aux publications antérieures (références [2] et [4]) pour les conditions exactes.
Ces trois molécules (ainsi que d’autres notamment décrites dans la référence [4], permettent de comparer leurs propriétés physico-chimiques (solubilité dans l'eau notamment) et biologiques (spécificité et efficacité envers l’enzyme ciblée), ce qui est crucial afin de choisir la molécule la plus efficace.
La molécule I initialement testée montra une sélectivité exceptionnelle pour les PDE-5 par rapport aux PDE-1 et PDE-3. Malheureusement, son manque de solubilité dans l’eau empêcha de poursuivre son développement (impossibilité de l’administrer efficacement sous forme de médicament) et poussa l’équipe de recherche à essayer différentes substitutions menant aux molécules II, III et IV. Toutes ces nouvelles molécules s’avérèrent plus solubles dans l’eau bien que légèrement moins actives. C’est évidemment la structure la plus active (molécule II) qui fut choisie pour les essais cliniques, puis commercialisée (voir référence [4] pour le détail du comparatif).
Repositionnement des médicaments
La synthèse du Sildenafil est un cas d’école intéressant pour voir les différences entre les synthèses développées en laboratoire, souvent développées pour leur praticité et l’introduction facile de substituants différents (encore une fois, utiles à l’optimisation d’un « hit » en « lead » par une synthèse divergente), et les synthèses industrielles qui se concentrent sur les rendements et la sécurité d’exécution (d’où le choix d’une synthèse convergente).
Si ces synthèses nous ont permis de revoir des notions essentielles de chimie, le composé que nous venons de prendre pour exemple soulève un second point intéressant.
En effet, le Sildenafil ne fut jamais commercialisé en tant que traitement pour l’hypertension ou l’angine de poitrine comme ce fut prévu à l’origine par les équipes de développement de Pfizer. Il est pourtant disponible dans toutes les pharmacies, sous le nom commercial de Viagra®.
Comment est-il possible que ce médicament soit prescrit pour un trouble différent de celui visé par les chercheurs ? Bref retour historique :
En tant qu’inhibiteur de PDE-5, le Sildenafil était destiné à traiter les problèmes cardiovasculaires par un mécanisme d’assouplissement des artères coronaires, permettant ainsi au sang de s’écouler plus facilement dans le myocarde. Les effets positifs recherchés sur le système cardiovasculaire n’ont jamais été observés lors des premiers tests cliniques sur patients volontaires à Sandwich (Angleterre) entre 1991 et 1992. Cependant, un grand nombre de volontaires masculins reporta un effet secondaire inattendu, s’illustrant par des érections persistantes quel que soit l’âge du patient. Après quelques recherches supplémentaires de la part du groupe R&D de Pfizer, il s’avéra que la PDE-5 est également une enzyme clé du processus biochimique contrôlant les érections, en faisant une cible de choix pour le traitement de l’impuissance (pathologie qui ne possédait aucun recours à cette époque !). Les tests cliniques pour le traitement des dysfonctions érectiles s’enchaînèrent sans incident à partir de ce point, amenant au médicament que nous connaissons aujourd’hui.
Cette problématique est celle méconnue du repositionnement des médicaments.
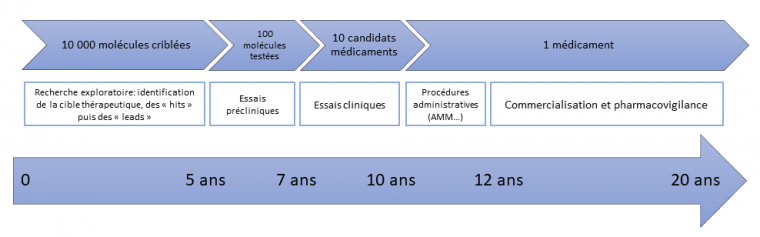
Comme illustré dans l’article de T. Ashburn et B. Thor (référence [7]) l’élaboration, les tests cliniques et la production industrielle d’un potentiel médicament avant son approbation par les autorités sanitaires qui délivrent les autorisations de mise sur le marché (AMM) des nouveaux médicaments - en France, il s’agit de l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM), aux Etats-Unis, il s’agit de la Food and Drug Administration (FDA) - et son arrivée sur le marché sont extrêmement coûteuses. Tout ce processus d’optimisation et de tests se chiffre en millions de dollars, et ces coûts ne cessent d’augmenter. Ces problèmes de coûts, de temps de développement, de concurrence et plus généralement de productivité peuvent pousser les experts du médicament à trouver d’autres usages pour des molécules prometteuses mais soumises à une trop forte concurrence dans leur domaine.
Les durées de chaque phase sont indicatives.
Cette stratégie de repositionnement permet de réduire drastiquement les coûts, les risques et les temps de développements, car dans ce cas, la recherche exploratoire, les démarches d’optimisation des « hits » en « leads » et les essais précliniques ont généralement déjà été faits. Le cas échéant, quelques études supplémentaires peuvent être nécessaires, pour vérifier le mécanisme d’action du futur médicament ou encore pour prouver que son action apporte un bénéfice significatif aux patients comparé aux traitements déjà existants.
Ces découvertes amenant à un repositionnement ont plusieurs origines : un effet secondaire inattendu (comme nous l’avons vu dans le cas du Sildenafil), de nouvelles preuves quant à un mécanisme d’action (induisant un autre usage possible), ou encore déterminé par criblage grâce aux banques nationales ou internationales de molécules connues.
Un autre cas remarquable de repositionnement est par exemple celui du Thalidomide, malheureusement connu pour avoir été prescrit dans les années 1960 aux femmes enceintes afin de traiter les nausées matinales, et qui provoqua un scandale après la découverte d’une action tératogène (c’est-à-dire produisant des malformations de l’embryon) causée par ce médicament. Logiquement, le Thalidomide fut banni de toutes les pharmacies, et il serait facilement tombé dans l’oubli sans un coup de poker mettant à jour une action insoupçonnée de cette molécule. En effet, il s’avère que le Thalidomide peut traiter l’érythème noueux, une pathologie se traduisant par des inflammations douloureuses et éruptives sur la peau. L’histoire veut qu’un patient, alors mourant du fait de cette maladie, se plaignait de ses douleurs persistantes. Son médecin, Jacob Sheskin, fouilla dans la pharmacie hospitalière jusqu’à tomber sur une boîte oubliée de Thalidomide. Non seulement le médicament permit au patient de passer une nuit sans douleurs, mais ses lésions cutanées semblaient effectivement apaisées.
Suite à cette découverte inattendue, de nouvelles recherches sur le mode d’action du Thalidomide contre l’érythème noueux eurent lieu, notamment au Vénézuela, qui se solda par environ 92% de patients guéris (référence 8. et 9.). Le Thalidomide fut finalement réhabilité par la FDA en juillet 1998 pour le traitement de l’érythème noueux.
Conclusion
À l’heure des grandes entreprises pharmaceutiques et des plus modestes biotechs (petites entreprises et start-up utilisant les biotechnologies pour, par exemple, développer des médicaments), la course aux médicaments s’intensifie de plus en plus pour contrer les menaces qui pèsent sur notre santé (cancers, sida, maladie d’Alzheimer…). Le nombre global d’essai cliniques en cours n’a jamais été aussi élevé qu’à notre époque, et le besoin de matériel de pointe pour continuer la recherche engendre des coûts également de plus en plus élevés.
Pour réduire les coûts, diverses parades ont été mises en place : agir directement sur les coûts de production et optimiser les procédés de fabrication chimique (synthèse convergente au lieu de linéaire comme nous avons pu le voir), ou encore repositionner les médicaments (ou plus généralement les molécules) existants grâce aux méthodes de criblage afin de cibler d’autres pathologies.
Références
- P. Vollhardt, N. Schore, Chemistry Structure and Function – sixth edition, W. H. Freeman and Compagny ; New York, NY, 2011.
- A. S. Bell, D. Brown, N. K. Terrett (Pfizer Inc. New York, N.Y.), US525534, 1992.
- P. J. Dunn, A. S. Wood (Pfizer Limited, Sandwich Kent, GB), EP0812845, 1996.
- A. S. Bell, D. Brown, N. K. Terrett, Bioorganic & Medicinal Chemistry Letters, 1996, 6, 15, 1819-1824.
- D. J. Dale, P. J. Dunn, C. Golightly, M. L. Hughes, P. C. Levett, A. K. Pearce, P. M. Searle, G. Ward, A. S. Wood, Organic Process Research & Development, 2000, 4, 17-22 (doi : 10.1021/op9900683).
- P. J. Dunn, Organic Process Research & Development, 2005, 9, 88-97 (doi : 10.1021/op040019c).
- T. T. Ashburn, K. B. Thor, Nature Reviews, 2004, 3, 673-683 (doi : 10.1038/nrd1468).
- R. Brynner, T. Stephens, Dark Remedy : The Impact of Thalidomide and Its Revival as a Vital Medicine, Perseus Publishing ; Cambridge, 2001.
- E. P. Sampaio, E. N. Sarno, R. Galilly, Z. A. Cohn, G. Kaplan, J. Exp. Med. 173, 699–703 1991.