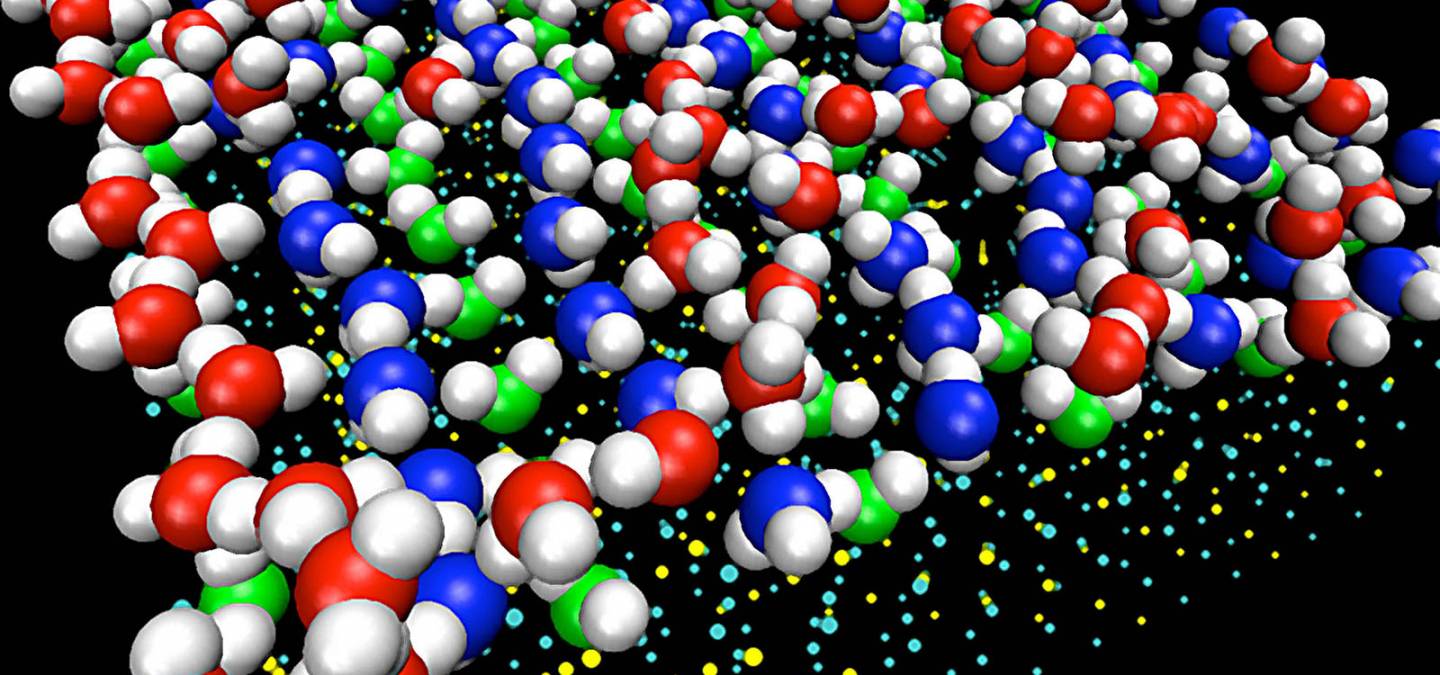
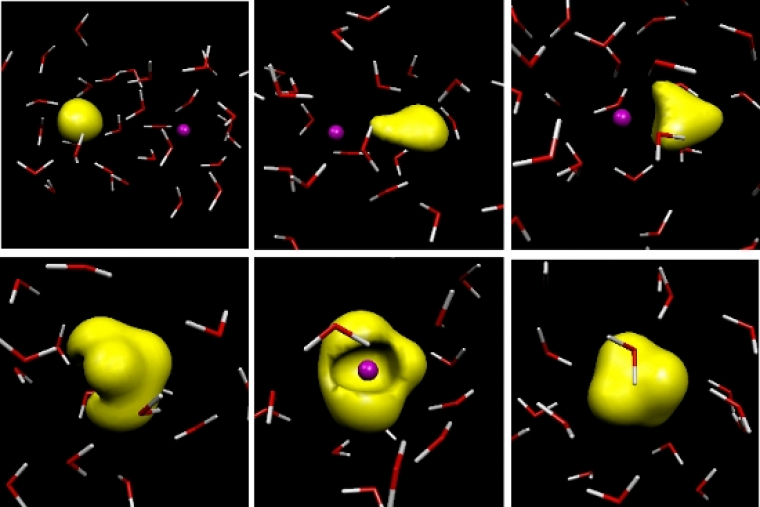
Apparue au milieu du XXe siècle, la simulation moléculaire est aujourd’hui un outil largement utilisé pour aider à interpréter et comprendre des résultats expérimentaux, tester de nouvelles théories, ou prédire le comportement physique ou chimique de la matière. Les méthodes de simulation moléculaire résolvent, de façon numérique, les équations de la thermodynamique statistique, théorie générale qui permet de faire le lien entre les grandeurs microscopiques du système (comme les positions et vitesses des atomes) et ses propriétés macroscopiques (structurales ou dynamiques).
Introduction
Apparue au milieu du XXe siècle, la simulation moléculaire est aujourd’hui un outil largement utilisé pour aider à interpréter et comprendre des résultats expérimentaux, tester de nouvelles théories, ou prédire le comportement physique ou chimique de la matière. Les méthodes de simulation moléculaire résolvent, de façon numérique, les équations de la thermodynamique statistique, théorie générale qui permet de faire le lien entre les grandeurs microscopiques du système (comme les positions et vitesses des atomes) et ses propriétés macroscopiques (structurales ou dynamiques).
Ces « expériences numériques » représentent de nouvelles voies d’exploration de la matière, en complément des théories et expériences, dans de nombreux domaines de la chimie, la physique et la biologie.
La thermodynamique statistique
Ludwig Eduard Boltzmann n’a pas pu utiliser la puissance des ordinateurs modernes, mais ce père de la thermodynamique statistique, fervent « atomiste », a permis aux chimistes théoriciens d’aujourd’hui de réaliser leurs propres expériences ! Elles ne sont certes ni « in vivo » ni « in vitro », mais la modélisation moléculaire est véritablement une expérience « in silico ». Depuis quelques dizaines d’années seulement, la simulation moléculaire, ou thermodynamique statistique numérique, a fait une entrée remarquable en chimie théorique.
Dans la deuxième moitié du XIXe siècle, la communauté scientifique internationale adopte progressivement l’idée selon laquelle la matière est faite d’atomes et de molécules. Un double défi est alors à relever. Il s’agit d’une part de développer des modèles de la matière à l’échelle microscopique (ce qui conduira au développement de la mécanique quantique), et d’autre part de faire ensuite le lien entre l’échelle atomique et l’échelle macroscopique, ce qui conduira à la thermodynamique statistique. Au premier de ces défis sont associés les noms de Bohr, Schrödinger, Heisenberg, de Broglie... Au second, ceux de Maxwell, Boltzmann et Gibbs. Einstein a quant à lui contribué à ces deux fronts de la connaissance (en plus de la
théorie de la relativité !).
Au moment où se produisent ces grandes évolutions scientifiques (au début du XXe siècle), le rêve est d’aboutir à une explication complète du monde fondée sur la description atomique. C’est ce que traduit la phrase de Jean Perrin : « Expliquer du visible compliqué par de l’invisible simple ». Aujourd’hui, on est plus circonspect sur le fait de savoir ce qui est « simple » et ce qui est « compliqué ». Il semble bien qu’une certaine forme de « complexité » se retrouve à toutes les échelles.
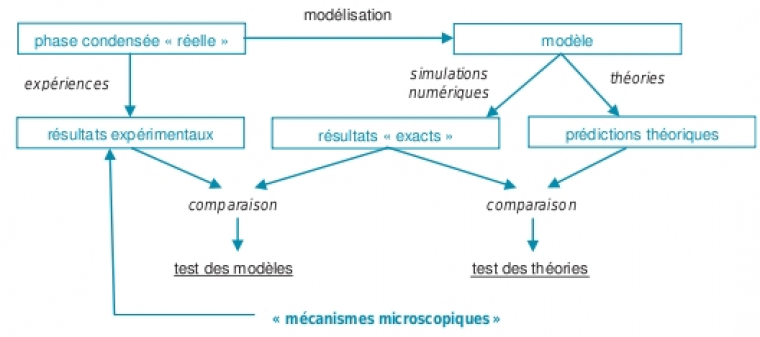
Il reste toutefois que l’interprétation des phénomènes macroscopiques à l’aide de mécanismes microscopiques est l’une des aventures intellectuelles les plus fascinantes qui soit. Pour cela, la thermodynamique statistique, par la voie traditionnelle analytique, ou plus récemment par la voie numérique (les simulations moléculaires) est un outil d’une grande utilité dans beaucoup de problématiques scientifiques contemporaines (voir figure 2).
Entre théorie et expérience
La simulation moléculaire donne une nouvelle dimension à l’étude de nombreux phénomènes physiques ou chimiques se produisant dans tous les états de la matière. Elle constitue une aide indéniable aux approches plus traditionnelles que sont la théorie analytique et l’expérience. Les approches théoriques font généralement appel à des approximations importantes et les interprétations des expériences sont souvent rendues délicates par la complexité des systèmes réels. De plus, il est pratiquement impossible de contrôler tous les paramètres expérimentaux ou de les faire varier sur une gamme aussi large qu’on le souhaiterait. Les comparaisons entre expériences et théorie peuvent être ardues, soit parce que l’observation expérimentale est difficile, soit parce que les modèles théoriques restent trop simples. Les prédictions théoriques sont souvent difficiles à valider expérimentalement lorsqu’elles utilisent des systèmes modèles trop éloignés de la réalité expérimentale.
Les simulations moléculaires se présentent comme une autre solution pour valider les modèles issus de la théorie ou pour en proposer d’autres. Les modèles utilisés doivent être suffisamment simples pour que les simulations soient réalisables en termes de temps de calcul, mais suffisamment réalistes pour reproduire au mieux la physico-chimie du phénomène étudié. Mais l’intérêt de la simulation moléculaire va au-delà de simples validations des modèles théoriques et reproductions quantitatives des résultats expérimentaux. Elle peut se substituer à l’expérience et devenir prédictive lorsque celle-ci est irréalisable (conditions extrêmes de température et de pression, dangerosité des réactifs, coût trop élevé...). D’autre part, elle peut être une alternative à la théorie lorsque les modèles analytiques sont trop complexes ou inexistants. (figure 3)
En outre, la simulation moléculaire permet une vision microscopique de la matière qui amène à mieux comprendre le déroulement de certains phénomènes (détail d’un mouvement moléculaire, d’une structure). De plus, l’extrême rapidité de certains événements à l’échelle microscopique est un handicap pour l’expérimentateur, alors que ces événements ultra-rapides peuvent être étudiés par simulation moléculaire.
Ainsi les expériences « in silico » trouvent-elles leur place entre théorie et expérience.
Quelques illustrations en vidéo
Diffusion du proton dans l'eau
Le proton solvaté H+ « saute » d'une molécule d'eau à une autre, conduisant à l'espèce H3O+ (en bleu).
Dissolution du trichlorure d'argent dans l'eau
Le trichlorure d'argent AgCl32- se dissout dans l'eau en dichlorure d'argent AgCl2- et chlorure Cl-.
Eau au sein d'une zéolithe
Une nano goutelette d'eau est adsorbée au sein d'une zéolithe (silicate poreux cristallin) [1].