Ce quatrième article du dossier Le stockage de l’énergie électrochimique en technologie Lithium-ion présente l'évaluation des performances des batteries Li-ion. Les critères principaux d'évaluation sont la capacité spécifique, la tension et la puissance accessibles, la cyclabilité et la tenue en température.
Le lecteur est invité à consulter au préalable les premiers articles du dossier, intitulés :
Critères d'évaluation
Les performances des matériaux d’électrodes sont évaluées à plusieurs niveaux, c’est-à-dire en demi-cellule (une des électrodes est du lithium métallique) ou bien en batteries Li-ion complètes et selon plusieurs critères, tels que :
- leur capacité spécifique ou charge pouvant être extraite par unité de masse ou de volume,
- la tension et donc la puissance accessible,
- leur cyclabilité, c’est-à-dire le nombre de cycles de charge/décharge accessibles avec évaluation :
- de l’efficacité coulombique (« Coulombic efficiency » : CE) à chaque cycle de charge et décharge (Qdécharge/Qcharge exprimée en %) et
- de la capacité de rétention du lithium (« Capacity retention » : CR) évaluée par rapport à sa capacité initiale mesurée lors du premier cycle de décharge (Qdécharge [cycle n] / Qdécharge [cycle 1] exprimée en %)
- leur tenue en température.
Une pseudo-électrode de référence au Lithium
Le potentiel d’une électrode de lithium métal au contact d’un sel de lithium peut s’écrire :
$$E_{Li^+/Li_{métal}}=E^0_{Li^+/Li_{métal}}+\frac{RT}{nℱ }Ln\left(\frac{a_{Li^+}}{a_{Li_{métal}}}\right)$$
avec E°Li+/Li le potentiel standard du couple Li+/LiMétal, l’activité des ions Li+ en solution et celle du lithium métal (égale à 1). Les potentiels des matériaux d’insertion du lithium ou ceux figurant sur les courbes de charge/décharge sont reportés par rapport au couple Li+/Li, il n’est donc pas surprenant de lire des valeurs proches de 5V pour les matériaux de cathode dits haute-tension. En pratique, ces potentiels sont mesurés en demi-cellule par rapport à une électrode de lithium métallique au contact d’un électrolyte de type PC – LiPF6 (1 mol.L-1), utilisée comme pseudo-électrode de référence de potentiel E ≈ -3V / ESH, bien que l’activité en ion Li+ ne soit pas égale à 1 ni constante lors d’une polarisation.
Tests en cyclage
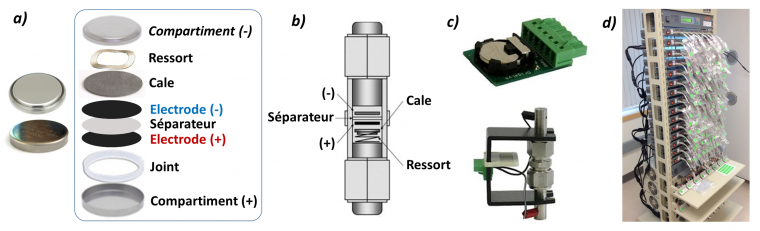
Les matériaux d’électrodes sont assemblés en demi-cellule ou bien en cellule complète sous forme de piles boutons, cellules swagelock© ou « pouch » (sachet en aluminium) pouvant être testées sur des cycleurs capables d’effectuer plusieurs milliers de cycles à courant contrôlé (galvanostat) ou bien à tension contrôlée (potentiostat) sur des dizaines de cellules en parallèle (voir Figure 1). D’autres mesures telles que la spectroscopie d’impédance électrochimique peuvent être implémentées afin d’identifier entre autres l’augmentation de la résistance interfaciale au transport des ions lithium et au transfert des électrons. Il est souvent intéressant d’insérer dans ces cellules une pseudo-électrode de référence afin de contrôler le potentiel aux électrodes (montage délicat de cellule à trois électrodes : électrode de travail, contre-électrode et électrode de référence).
Les demi-cellules et cellules complètes peuvent être montées sous forme de pile-bouton (« coin-cell », (a), ou bien de cellule Swagelok © (b) et installées sur un cycleur (galvanostat, potentiostat) permettant d’évaluer en parallèle les performances en cyclage de dizaines de batteries (c et d). Crédits photos : Origalys et Neware
Courbes de charge/décharge
Comment lire les courbes de charge/décharge ?
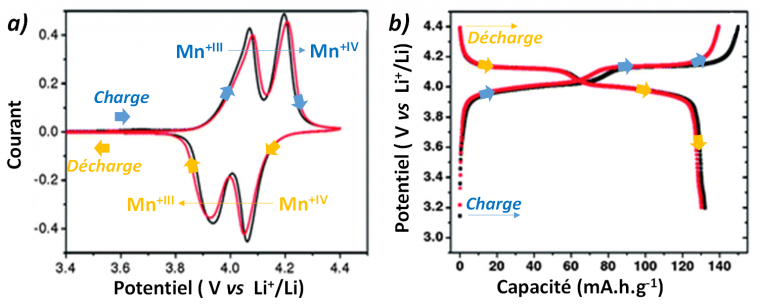
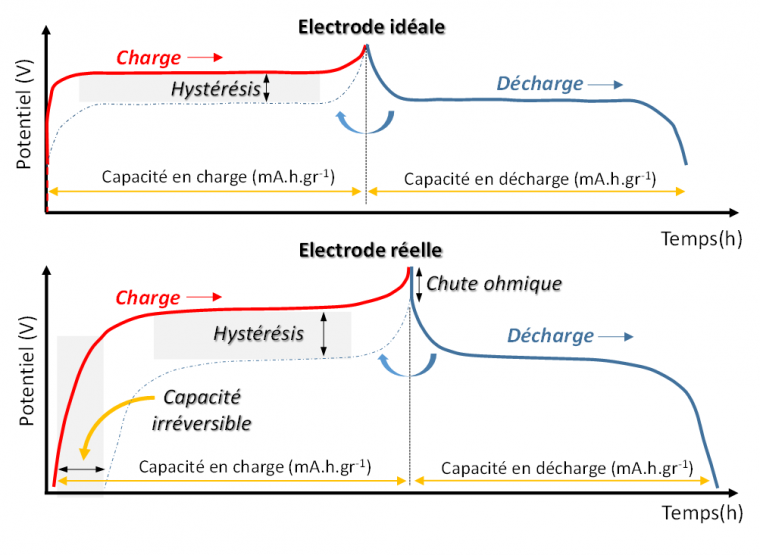
Les courbes intensité-potentiel (I-E) tracées en mode potentiostatique (avec balayage contrôlé du potentiel à vitesse constante) permettent de visualiser aisément les potentiels thermodynamiques correspondant aux différents processus redox, par exemple la transformation du manganèse du degré d’oxydation +III en +IV au sein du matériau spinelle LMO (voir Figure 2a). Les deux pics de courant en oxydation (et réduction) peuvent s’expliquer par le changement de structure de spinelle vers sel lors de la délithiation. Les courbes I-E ne renseignent cependant pas sur la cinétique des processus (quantité de lithium extraite ou insérée par seconde), on préfère donc utiliser les courbes de charge/décharge à courant constant (c’est le mode galvanostatique, dans lequel la variation de potentiel du matériau au cours du temps E = f(t) renseigne sur le taux de lithiation du matériau). Sur les courbes de charge/décharge, on retrouve bien les valeurs de potentiel associées aux différents processus redox (valeurs de plateau Figure 11b). Le temps représenté en abscisse peut être converti en charge électrique échangée Q = i(mA)×t(h) par gramme ou litre de matière active, c’est-à-dire en capacité spécifique massique C = Q/m (m.A.h.g-1) ou volumique C = Q/V (m.A.h.L-1). La représentation de la variation de potentiel en fonction de la capacité mesurée permet de visualiser si la capacité théorique du matériau est atteinte et si elle diminue au cours des cycles de charge et décharge. Cette diminution, qui représente la capacité perdue, dite « irréversible », peut être liée à une perte de matière active (dissoute ou bien isolée électriquement), ou à une consommation de charge de façon irréversible associée à l’oxydation ou à la réduction de l’électrolyte.
a) Courbe intensité-potentiel (I-E) montrant la charge et la décharge (pour deux cycles : 1er noir, 2e rouge) du matériau spinelle d’électrode positive LMO lors d’une polarisation avec contrôle du potentiel (voltampérométrie cyclique : CV) ; b) courbe de charge/décharge montrant des plateaux de potentiel de valeurs similaires à celles lues sur les courbes I-E. La différence de capacité entre la courbe de charge et de décharge correspond à la perte de capacité, dite irréversible.
Figure adaptée de J. Mater. Chem. A 1 (2013) 8170-8177.
Calcul de la capacité disponible du système
A partir du profil de charge/décharge à courant i constant en fonction du temps, il est possible de calculer la capacité disponible du système.
- Les profils peuvent présenter des longueurs variables en fonction de la charge accessible Q et apparaître sous forme de courbes en « S » ou de plateau (parfois plusieurs) en fonction du mécanisme de lithiation. Les variations importantes du potentiel associées impacteront l’énergie accessible (E(J) = U*Q), soit l’autonomie d’un véhicule électrique par exemple.
- La plage de potentiel de fonctionnement du matériau (écart en potentiel entre le matériau lithié et délithié) et sa nature détermineront sa propension à réagir avec l’électrolyte et donc à le « consommer » (SEI, CEI) lors de processus irréversibles. Ceci peut être évalué par la capacité de rétention du matériau au cours du cyclage (rapport de capacités entre charge et décharge exprimé en %).
- La capacité restituable lors d’un cycle de charge/décharge dépend fortement de la densité de courant appliquée, c’est-à-dire de la vitesse de charge ou de décharge, exprimée en multiple de la capacité du matériau, dit « C-rate». L’évaluation à différents C-rate des profils de charge/décharge permet de connaître les valeurs de courant utilisables et la puissance disponible tout en garantissant une utilisation sûre de la batterie (pas d’emballement thermique).
C-rate et Capacité
Le régime de (dé)charge ou C-rate, exprimé comme un multiple de C, correspond au rapport du courant i appliqué (c’est-à-dire à la vitesse de (dé)charge) sur la capacité C de la batterie.
$$\textrm{C-rate}=\frac{i}{C}$$
Au régime 10 C la batterie sera déchargée 100 fois plus vite qu’à 0,1 C. Ainsi une batterie de 1000 mA.h devra fournir 1000 mA ( soit 1 A = 1 C.s-1) pendant 1 heure à 1 C, ou bien 500 mA (soit 0,5 A = 0,5 C.s-1) pendant deux heures à 0,5 C.
Exemple d’une électrode composite de masse 10,0 mg composée à 90% en masse de graphite (Cgraphite = 372 mA.h.g-1) et de surface S = 2,00 cm².
Sa capacité est : $C=C_{graphite}×m_{graphite}$
soit C = 372 × 0,0100 × 0,9 = 3,35 mA.h
Le courant à appliquer (en mode galvanostatique) pour (dé)charger l’électrode composite de graphite au régime de (dé)charge 0,5C, c’est-à-dire en 2 heures est :
$i=\textrm{C-rate}×C$ = 3,35 × 0,5 = 1,68 mA
et la densité de courant vaut : $j = \frac{i}{S}$ ~ 837 µA.cm-2
Phénomène de polarisation ou surtension
La tension de cellule s'exprime ainsi : (Ec - Ea) – ηtot – Ri
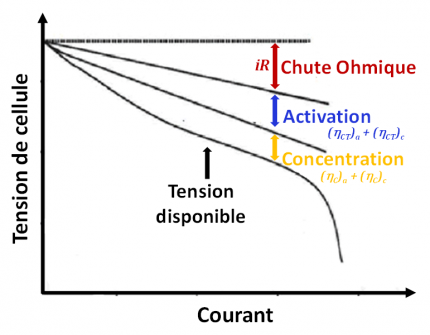
La variation de capacité avec le régime de charge/décharge peut être expliquée par un phénomène de polarisation ou surtension η (en V) qui a trois contributions :
- la chute ohmique Re(Ω)*i(A) liée à la résistance de l’électrolyte et à la résistance de contact des différents composants de la cellule,
- la polarisation d’activation liée à la résistance de transfert de charge RCT à l’interface électrode/électrolyte,
- et la polarisation de concentration qui est inhérente à l’apparition de gradient de concentration en sel de lithium au sein de l’électrolyte lors de réactions de charge/décharge rapides. De par un nombre de transport faible (fraction de courant transporté par un ion i) du lithium pour la plupart des sels (t+ < 0,5), des variations importantes de concentration en électrolyte aux électrodes (diminution ou augmentation) sont observées aux régimes élevés (jusqu’à 4 mol.L-1 en régime 3C).
Cette polarisation se traduit par une hystérésis de potentiel observée entre les courbes de charge et de décharge.
Polarisation ou surtension
Afin d’obtenir des batteries haute énergie, le phénomène dit de « polarisation » (ou chute de potentiel) associé aux réactions électrochimiques doit être minimisé. Ce dernier, qui dépend fortement de la densité de courant appliquée, a trois origines : la polarisation ohmique (ou chute ohmique R × i), et les polarisations de transfert de charge et de concentration (surtensions ηCT et ηC, à la fois anodiques et cathodiques).
Hystérésis et capacité irréversible
Sur une électrode (une cathode ici) les plateaux1 observés pendant la charge (délithiation) et la décharge (lithiation) n’apparaissent pas au même potentiel. Cette hystérésis a plusieurs origines :
- la stabilisation en énergie (et en potentiel) pendant la décharge à la fois des orbitales d du métal de transition lors de l’injection d’électrons et de la structure du matériau hôte lors de l’insertion des ions Li+ dans les espaces interstitiels.
- le coût en énergie supplémentaire en charge nécessaire pour promouvoir les ions et les électrons à partir de niveaux d’énergie inférieurs.
- les phénomènes de polarisation incluant la chute ohmique.
Les plateaux peuvent aussi présenter des longueurs inégales qui sont liées aux réactions électrochimiques secondaires irréversibles, telles que l’oxydation de l’électrolyte ou bien la perte de matière active (par dissolution, changement de structure ou de composition, ou isolation électrique).
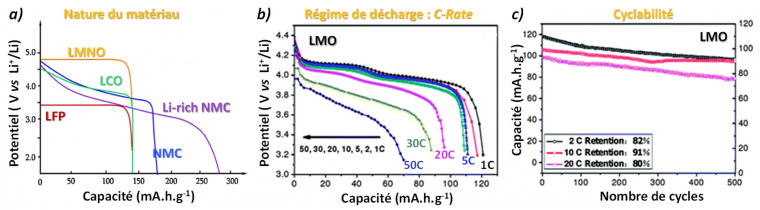
Les différents critères d'évaluation des performances des matériaux d'électrode sont illustrés sur la figure 5 regroupant les courbes de décharges de quelques matériaux d'électrodes positives :
- ces derniers, de composition et structure cristalline différentes, présenteront soit des plateaux, soit une variation progressive de leur potentiel de fonctionnement en fonction du mécanisme de (dés)insertion du lithium, et atteindront une capacité spécifique (massique ici) plus ou moins élevée de rétention (stockage) du lithium,
- un même matériau, LiMn2O4 (LMO) ici, montrera une chute d'autant plus rapide de son potentiel de fonctionnement et donc une capacité spécifique atteinte d'autant plus faible, que le régime de décharge (C-rate) sera élevé,
- enfin la cyclabilité du matériau d'électrode, c'est-à-dire sa capacité à maintenir sa capacité de rétention du lithium au fur et à mesure des cycles de charge/décharge, pourra être évaluée en pourcentage de rétention de sa capacité initiale.
a) Profil de décharge de différents matériaux d’électrode positive mettant en évidence leur performances énergétiques variées ; b) influence du C-rate sur LiMn2O4 - Lorsque la densité de courant appliquée en décharge augmente (vitesse de décharge), la capacité extractible chute ; c) performances en cyclage de LiMn2O4 - La capacité du matériau décroît inéluctablement avec le nombre de cycles (phénomènes de dégradation multiples).
Figure adaptée de J. Mater. Chem. A 1 (2013) 8170-8177.
Diagnostic operando
La compréhension des mécanismes de fonctionnement ou de dégradation des performances des matériaux de batteries au lithium a été possible par la mise en œuvre de techniques d’analyse croisées des matériaux après cyclage (diagnostic post-mortem ou ex situ), telles que les spectroscopies vibrationnelles (Infrarouge, Raman), photoélectronique X (XPS), de masse (TOF-SIMS), d’absorption des rayons X (XANES, EXAFS), Mössbauer – et les microscopies électroniques (MEB, MET, STEM), les microscopies X à transmission (tomographie STXM) et à champ proche (AFM, nanoInfrarouge, nanoRaman). Le changement de composition des électrolytes peut être étudié par spectroscopie de masse (GC-MS) ou par résonance magnétique nucléaire (RMN). La stabilité en température des électrodes au contact d’électrolyte peut être déterminée par des méthodes thermogravimétriques (ATG) ou calorimétriques (DSC). Le coefficient de diffusion de Li+ au sein des matériaux actifs peut être évalué par des méthodes de titration électrochimique utilisant des pulses de potentiel (PITT) ou de courant (GITT).
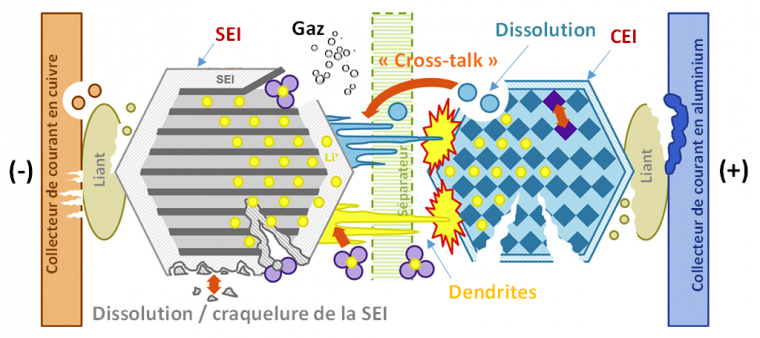
Une somme de problèmes à la fois au niveau de la matière active, des additifs et des collecteurs de courant, résumés Figure 6, peuvent expliquer la dégradation des performances, parmi lesquels le dépôt du lithium métallique à l’anode (formation de dendrites), l’instabilité de la SEI au cours des cycles (dissolution/reformation), la dissolution du matériau de cathode, la diffusion du métal de transition dissous vers l’anode et son intégration à la SEI (« Cross-talk »).
Ces mécanismes peuvent être étudiés par des méthodes d’analyse implémentées operando, c’est-à-dire pendant la polarisation de la batterie, afin d’observer leur dynamique.
Image adaptée de J. Pow. Sources, 341 (2017) 373.
Lors de l’analyse ex situ des matériaux, l’interaction rayonnement-matière (pour les sondes électroniques et X) ainsi que la possible exposition de l’échantillon à l’air peuvent impacter les observations et les conclusions associées. Depuis le début des années 2000, les méthodes implémentées en conditions dites in situ ou operando, qui analysent le matériau de batterie en fonctionnement (demi-cellule ou cellule complète), sont privilégiées afin d’accéder à la dynamique des processus, c’est-à-dire au changement de structure et de composition du matériau et de l’interface électrode/électrolyte en fonction de l’état de charge. On peut citer les mesures microscopiques (MET, AFM, STXM) et spectroscopiques (IR, Raman, XANES, RMN), les mesures gravimétriques (microbalance à cristal de quartz électrochimique : EQCM), les mesures de Spectrométrie de Masse Electrochimique Différentielle (DEMS : identification des gaz produits) et les mesures de spectroscopie d’impédance électrochimique (EIS). Les mesures IES, qui apportent de nombreuses informations sur l’état de santé des cellules et des modules dans les packs de batterie (résistance interfaciale, résistance d’électrolyte), pourraient être intégrées au BMS dans un futur proche.
Une liste des acronymes utilisés dans tout le dossier, ainsi qu'une version au format PDF de cet article sont fournies ci-après.
Documents à télécharger