D'une idée « naturelle », l’eau apparaît comme le solvant le plus vert qu’il soit. Bien qu'utilisée comme solvant depuis les débuts de la synthèse organique, l’émergence du concept de chimie verte a généré un regain d’intérêt pour l’eau en tant que solvant. Néanmoins, son utilisation comme solvant pose plusieurs difficultés que nous abordons dans cet article.
Introduction
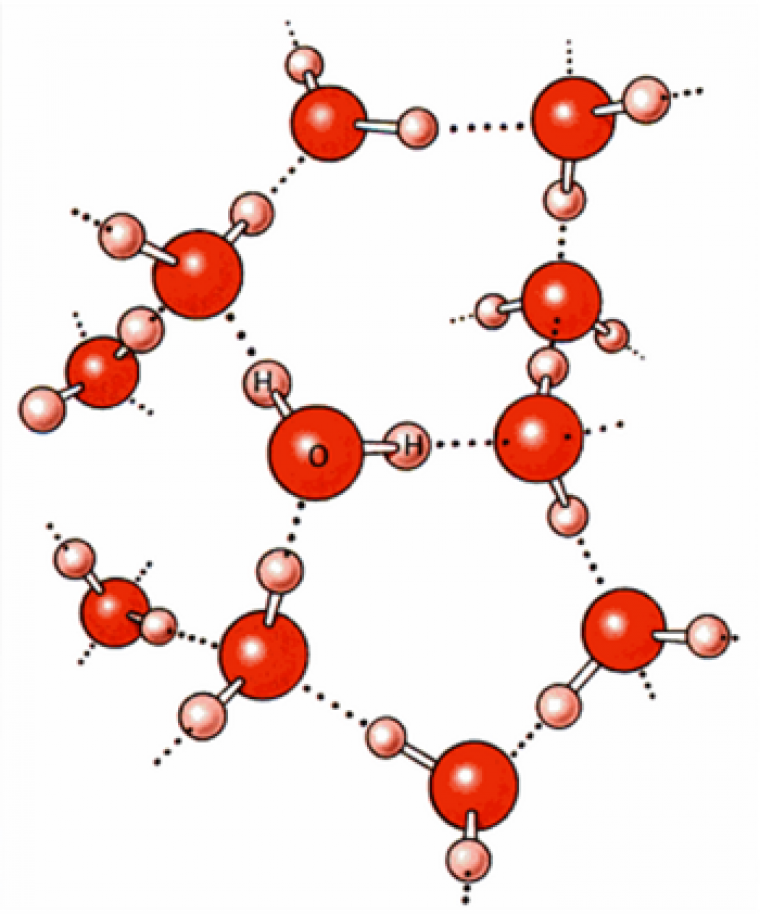
L'eau est la molécule la plus abondante sur Terre et elle présente de nombreux avantages : elle est non toxique, sans danger pour la santé, non inflammable. C’est un solvant polaire (avec une permittivité relative importante : εr ≈ 78 ) et une structure interne dominée par un réseau de liaisons hydrogène ou laisons-H (Figure 1). En particulier, l’utilisation d’eau comme solvant pour des réactions de Diels-Alder conduit à une augmentation des vitesses de réaction et de la sélectivité du fait d’une combinaison entre effets hydrophobiques et effets liés aux liaisons-H.
Néanmoins, l’utilisation de l'eau solvant pose plusieurs difficultés.
Les contraintes de l'eau solvant
Même si la température d’ébullition de l'eau offre l’avantage de pouvoir agir comme un dissipateur d’énergie pour des réactions exothermiques, chauffer l’eau demande beaucoup d’énergie. De fait, une fois contaminé, purifier un produit dans l’eau est difficile et coûteux en énergie.
L’eau peut également agir comme réactif avec des électrophiles et des nucléophiles, limitant le panel des réactifs qui peuvent être utilisés en solution aqueuse, ce qui a conduit à son remplacement par des solvants organiques. Par exemple, dans la synthèse de l’urée à partir de cyanate d’ammonium en solution aqueuse, 30 % du cyanate est consommé par hydrolyse.
Par ailleurs, la faible solubilité de nombreux solutés potentiels limite l’utilisation de l’eau comme solvant. Beaucoup de techniques ont été mises au point pour répondre à ce problème :
- L’ajout de groupement hydrophile peut être une solution mais nécessite une étape supplémentaire pour ôter ce groupement, ce qui est similaire à une étape de protection/déprotection donc particulièrement déconseillé en terme de chimie verte.
- L’utilisation d’un co-solvant organique permet également d’augmenter la solubilité des réactifs mais produit des déchets nécessitant une purification, de même que l’addition d’autres agents auxiliaires de solubilisation.
- Chauffer l’eau pour augmenter la solubilité et le souci de coût énergétique que cela entraîne.
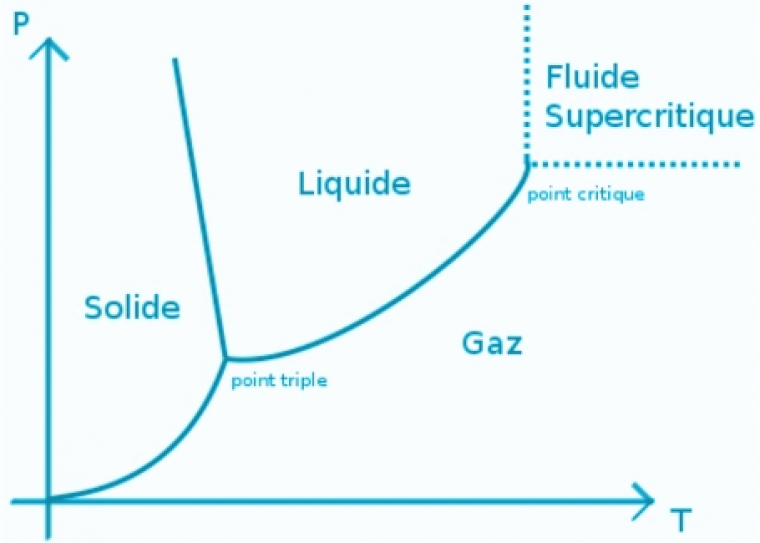
En particulier, l’eau chauffée sous pression au-dessus de son point d’ébullition entraîne un changement de sa structure du fait de la réduction de l’étendue et de la résistance des liaisons-H : la permittivité relative passe de 78 à température ambiante à 21 à 300 °C puis à 4.1 à 500 °C. Ces changements impliquent des propriétés physicochimiques totalement différentes, à commencer par un renversement des solubilités : les composés non polaires deviennent solubles et les sels insolubles. L’eau supercritique (Figure 2) au-delà du point critique (Tc = 374 °C et Pc = 218 bars) est un fluide pour lequel il n’y a plus de phases liquide et gaz distinctes mais une unique phase « supercritique ». Globalement, on constate que la capacité de l’eau à établir des liaisons-H avec des solutés - ce qui domine son comportement à température ambiante - est grandement réduite ainsi que sa capacité à interagir avec les solutés par des interactions dipolaires. Pour beaucoup de composés organiques, on observe alors une miscibilité totale dans l’eau supercritique.
Cependant cela ne résout pas le problème de la réactivité de l’eau : même à haute température, beaucoup de groupes fonctionnels sont susceptibles de s’hydrolyser. En particulier, quand le produit de la réaction est un acide, le problème de la réactivité de l’eau est d’autant plus grand que l’augmentation du produit ionique de l’eau avec la température favorise l’activité catalytique de petites concentrations d’acide. Ceci limite l’utilisation de l’eau pour les synthèses, d’autant que l’équipement pour de telles réactions doit être protégé de la corrosion acide.
Enfin, le coût énergétique pour atteindre ces températures et pressions est important, ce qui réduit l’utilisation de l’eau comme solvant pour la synthèse de molécules organiques complexes.
Les applications de l'eau solvant dans la synthèse
La conversion de la biomasse
Parmi les constituants de la biomasse, le chimiste s'intéresse plus particulièrement à la biomasse lignocellulosique, composée de cellulose (un polymère linéaire de glucose), d’hémicellulose (un polymère branché contenant entre autres du glucose et des xyloses), de lignine, de lipides et de terpènes.
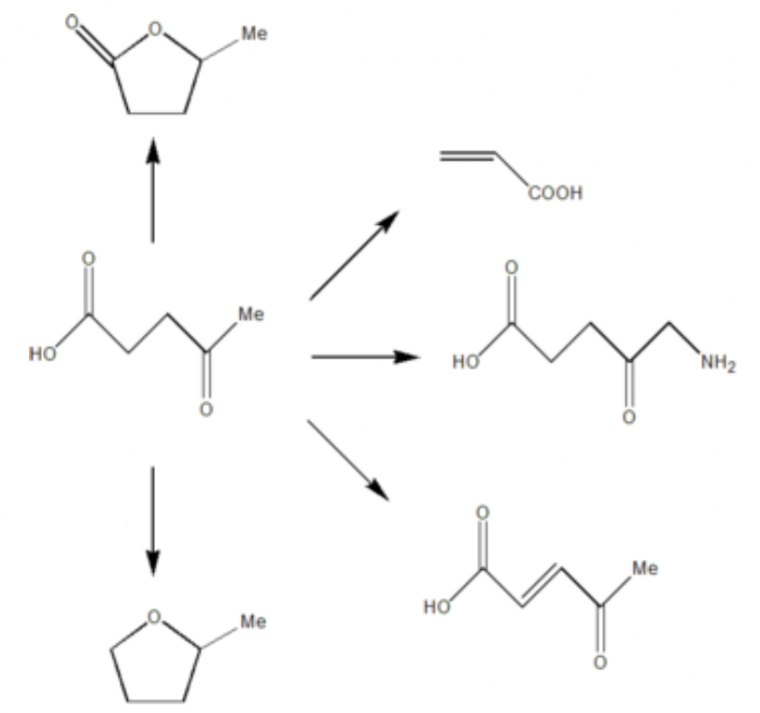
Ainsi, l’eau à haute température permet la conversion de la biomasse lignocellulosique en acide lévulinique dans un processus d’hydrolyse catalysée par acide. Si les mécanismes de réactions ne sont pas entièrement élucidés, cette conversion est de grand intérêt (Figure 3).
L’acide lévulinique est en effet considéré comme un composé organique central pour une future industrie chimique reposant sur la biomasse : de nombreux composés utiles en sont des dérivés.
La destruction des déchets
Il s’agit de répondre à une grande préoccupation des chimistes verts. L’oxydation par eau supercritique - notée sc-H2O - est une technologie qui décompose complètement les déchets organiques domestiques et industriels en dioxyde de carbone (CO2), en eau et en diazote (N2). Outre l'intérêt commercial, cette technologie permet de répondre à une grande préoccupation du chimiste, à savoir : comment traiter les déchets après purification ? La miscibilité complète de sc-H2O en présence de dioxygène avec de nombreux composés organiques rend la méthode excellente pour détruire tous matériaux oxydables.
L’introduction de ce traitement des déchets à l’échelle industrielle présente encore des défis, non pas du point de vue chimique mais du point de vue technologique. En particulier, il nécessite de développer des réacteurs capables de résister aux conditions de réaction extrêmement corrosives et de gérer la formation de sels, insolubles dans sc-H2O. Plusieurs installations d’oxydation par sc-H2O ont été créées, notamment par EcoWaste Technologies ou par Johnson Matthey, dans le cadre de traitement des déchets de l'industrie pétrochimique ou catalytique (Figure 4). Mais beaucoup des sites ont fermés suite aux difficultés technologiques rencontrées telles la forte corrosion des réactions.
Actuellement, le traitement des déchets par sc-H2O est utilisé dans la destruction des armes chimiques.
Les réactions « sur l'eau »
Les réactions dites « sur l’eau » reposent sur la non-miscibilité de nombreux composés organiques avec l’eau. Cette technique est développée, il y a quelques années, par K. Bary Sharpless (Prix Nobel de Chimie 2001). Etudiant une réaction de cycloaddition, Sharpless et son équipe constatent que le temps de réaction passe de deux jours en milieu 1:1 sans solvant à seulement 10 minutes dans un mélange hétérogène contenant de l'eau. Les rendements des deux réactions sont par ailleurs similaires, supérieurs à 80 %.
Ainsi des réactions entre composés organiques qui ne se dissolvent pas dans l’eau peuvent être optimisées en dissolvant les réactifs dans des mélanges hétérogènes contenant de l’eau et sans l’ajout d’un quelconque co-solvant organique. L’eau agit alors comme un catalyseur hétérogène : l’augmentation de la vitesse de réaction s’explique justement par la structure particulière de l’eau.
Dans les conditions ambiantes, l'eau est décrite comme un tétraèdre au sein duquel chaque molécule d’eau est liée par une liaison-H à deux autres molécules d’eau par ses deux atomes d’hydrogène et à deux autres molécules d’eau par son oxygène. Or à la surface du mélange hétérogène « par couche », cette structure est impossible. De fait, 25 % des groupes hydroxyle ne sont pas liés et restent donc disponibles. Ces groupes agissent alors comme donneurs de liaisons-H pour les composés hydrophobes avec lesquels ils sont en contact, catalysant la réaction.
La méthode a été étendue à de nombreuses réactions et à des applications industrielles, en particulier dans l'industrie pharmaceutique.
La catalyse par transfert de phase
La Catalyse par Transfert de Phase (CTP) est une technique bien connue dont on connaît le potentiel pour offrir des voies de synthèses en chimie verte. Les avantages de la CTP - augmentation de la vitesse de réaction, stéréospécificité, catalyseurs peu coûteux… - ont rapidement conduit à son application commerciale : plus de 600 processus industriels de la chimie fine à de l’industrie pharmaceutique reposent sur cette méthode.
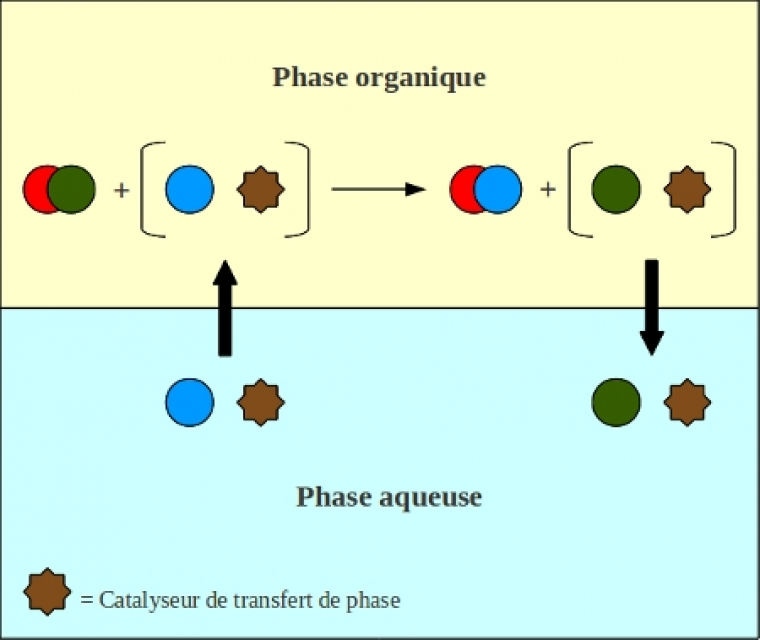
Le principe est simple : un catalyseur est ajouté pour permettre le transfert d’un réactif d’une phase liquide (généralement aqueuse) vers une autre phase (généralement organique) afin qu’il puisse y réagir avec un autre réactif. Habituellement, on assiste au transfert d’un anion d’une phase aqueuse vers une phase organique où il n'est pas miscible (Figure 5). Il existe différents types de catalyseurs de transfert de phase ; on utilise généralement des sels d'ammonium quaternaire ou des éther-couronnes.
Une des applications majeures de la Catalyse par Transfert de Phase concerne les réactions d’oxydations, particulièrement problématiques en terme de chimie verte. En effet, les oxydants traditionnels (permanganate de potassium KMnO4 ou dichromate de potassium K2Cr2O7) génèrent des déchets métalliques délicats à traiter. De même, les oxydants chlorés produisent des déchets dangereux pour l’environnement. En revanche, comme le seul produit secondaire de son utilisation est l’eau, l'eau oxygénée (H2O2) semble une alternative pratique en tant qu'oxydant en chimie verte. La nature aqueuse de H2O2 le rend idéal pour la méthode CTP afin de permettre son transfert de la phase aqueuse vers la phase organique où H2O2 réagit avec le composé organique à oxyder.
Bibliographie et ressources en ligne
[1] Introduction à la chimie verte
[2] J.H. Clark , S.J. Tavener, Org. Process Res. Dev., 11, 149 (2007).
[3] Les concepts de la chimie verte : utilisation atomique et facteur E
[4] C. Reichardt, T. Welton, Solvents and Solvent Effects in Organic Chemistry, 4th Ed., Wiley-VCH.
[5] Solvants et chimie verte 1/3 : Les solvants en chimie organique
[6] Solvants et chimie verte 3/3 : Des solvants alternatifs « verts »