La chimie verte a pour but de concevoir des produits et des procédés chimiques permettant de réduire voire d’éliminer l’utilisation et la synthèse de substances dangereuses. Il s’agit d’encourager les chimistes à considérer l’impact environnemental des produits chimiques et de leur synthèse dès la conception.
Introduction
L’impact des produits chimiques sur l’environnement est un sujet de plus en plus débattu. De nombreuses législations ont été mises en place pour répondre à ces inquiétudes et encourager l’introduction de nouvelles méthodes de production qui soit intéressante sur le plan économique et écologique.
Le concept de « chimie verte » (green chemistry) émerge aux Etats Unis au début des années 1990 pour offrir un cadre à la prévention de la pollution liée aux activités chimiques.
La chimie verte a pour but de concevoir des produits et des procédés chimiques permettant de réduire voire d’éliminer l’utilisation et la synthèse de substances dangereuses. Il s’agit d’encourager les chimistes à considérer l’impact environnemental des produits chimiques et de leur synthèse dès la conception.
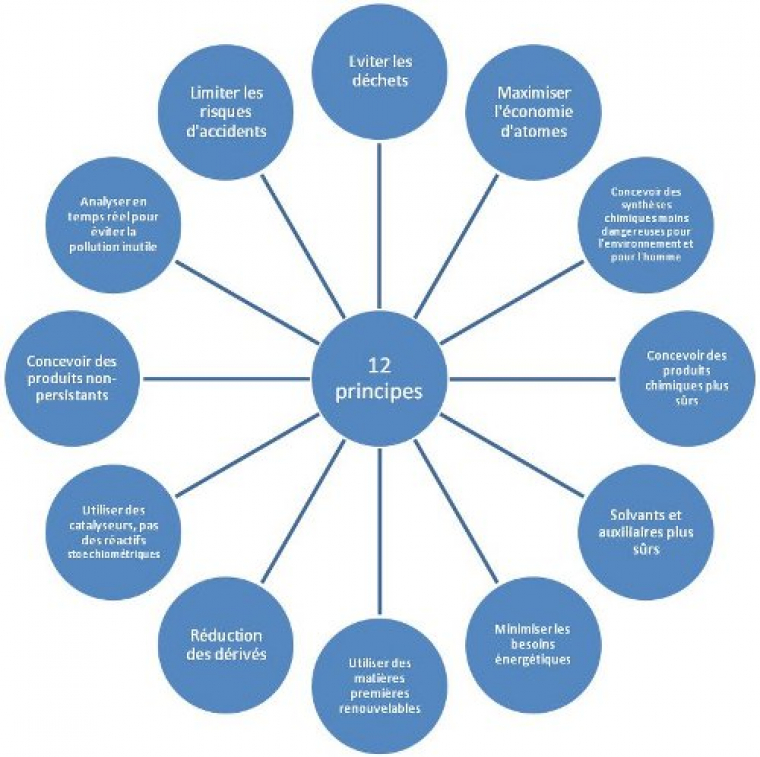
La chimie verte s’articule autour de douze principes, énoncés par Anastas et Warner [1], pères de la chimie verte (Figure 1). Ils reposent sur l’aspect environnemental et économique ainsi que sur la sécurité :
La chimie verte doit s’inscrire dans un développement économiquement efficace et durable ; de nouveaux procédés de synthèse doivent prendre en compte l’aspect écologique. Une partie des activités de la chimie verte consiste donc à diminuer la quantité de sous-produits des réactions chimiques et les déchets toxiques. Les solvants de réactions entrent dans cette catégorie.
État des lieux
La plupart des solvants sont des composés organiques volatils (ou VOC, volatil organic compounds) qui peuvent donc se disperser facilement dans l’environnement. Cela s’accompagne souvent de risques car ils sont très souvent inflammables. De plus, ils sont généralement nocifs du point de vue de l’écologie et de la santé (beaucoup présentent à la fois une toxicité aiguë et une toxicité chronique). Ces inquiétudes sont d’autant plus justifiées que les solvants sont utilisés en grandes quantités :
- 35 % des VOCs libérés dans l’atmosphère sont des solvants ;
- 80 à 90 % des déchets générés par l’industrie pharmaceutique proviennent du solvant utilisé ;
- et l’utilisation de solvant est responsable de la moitié des émissions de gaz à effet de serre.
Ainsi, l’un des sujets de préoccupation majeure en matière de chimie est l’utilisation de substances auxiliaires, et surtout de solvants. De fait, le cinquième principe de la chimie verte encourage à limiter leur emploi.
Limiter l'utilisation des solvants
Même si certains procédés industriels ont lieu en phase gazeuse avec des catalyseurs solides - donc sans solvant -, dans la plupart des réactions, en particulier la synthèse de molécules complexes, il est impossible de se passer de solvant. Cependant, la quantité de déchets produits est souvent lié au nombre de pas de synthèse nécessaires. Il apparaît donc très clairement que réduire le nombre de pas de synthèse aboutit à une diminution nette de la production de déchets.
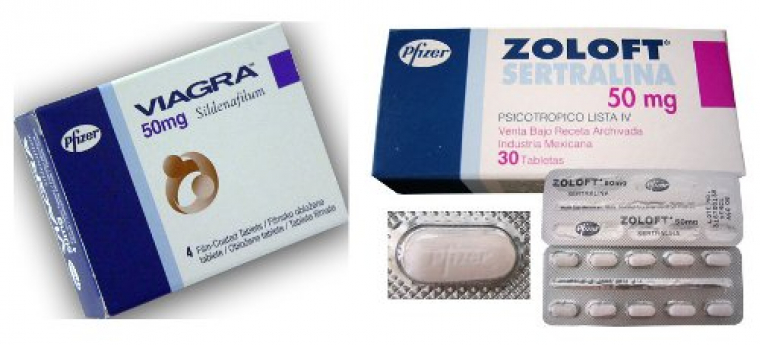
Prenons l’exemple de la synthèse du Viagra© (Figure 2) : à l’origine, le procédé de synthèse utilisait 1300 L/kg de solvant contre 7 L/kg seulement pour le procédé actuel optimisé.
En réalité, ce n’est pas tant le nombre de pas de synthèses distincts qui importe mais le nombre de séparation et de changement de solvants au cours de la synthèse.
Dans la synthèse de la sertraline, un antidépresseur mis au point par Pfizer, les trois dernières étapes de la synthèse ont été modifiées pour pouvoir être menées dans l’éthanol sans besoin d’isoler les produits intermédiaires. Cette amélioration de stratégie de synthèse aboutit à une réduction du solvant utilisé de 101,4 L/kg à 24 L/kg.
La première étape pour minimiser l’utilisation de solvants consiste en la conception de voies de synthèse qui limitent voire excluent les changements de solvants en privilégiant la récupération et le recyclage de ce dernier.
Choisir un solvant vert
Lorsqu’on ne peut pas travailler sans solvant, il s’agit alors de choisir celui dont les effets néfastes sur l’environnement sont les plus faibles. La question est alors de déterminer le caractère « vert » d’un solvant. Dans l'absolu, il n’y a pas de solvant « vert » ; le caractère plus ou moins « vert » d’un solvant ne peut être déterminé que dans le contexte d’un procédé.
Par exemple, même l’eau - qui semble a priori le solvant le moins dangereux pour l’environnement - n’est pas nécessairement le solvant le plus « vert ». Du fait de son haut point d’ébullition, l’eau requiert beaucoup d’énergie pour être éliminé d’une synthèse par évaporation, ce qui conduit à une production importante de CO2. Il vaut mieux parfois utiliser un solvant apparemment moins vert au sein duquel le produit désiré peut être plus facilement extrait.
Le choix du solvant affecte également le rendement, la sélectivité et les vitesses de réactions. Un choix vigilant et attentif du solvant peut réduire la production de déchets et/ou l’énergie utilisée au cours d’un procédé. Pour concevoir une synthèse la plus « verte » possible, la prise en compte de ces considérations multi-factorielles est donc essentielle.
Pour évaluer le caractère « vert » d’un solvant, plusieurs outils ont été développés afin d'établir une classification de leur impact environnemental :
- L’outil EHS (Environmental Health and Safety) évalue les risques environnementaux directs d’un composé.
Plusieurs facteurs interviennent dans le calcul : la persistance, les risques de libération, d’incendie et d’explosions, les réactions et décompositions possibles, la toxicité (aiguë ou chronique). Pour un composé donné, une valeur est attribuée à chaque facteur : la somme donne alors le profil EHS du composé étudié. L’avantage de cette méthode est de couvrir la plupart des préoccupations environnementales tout en restant simple d’usage. Si aucun solvant ne présente d’avantage évident, une telle classification constitue donc un premier outil efficace de sélection d’un solvant vert.
-
Les résultats EHS peuvent être combinés avec ceux de l’outil LCA (Life Cycle Assessment) pour donner une méthode de sélection plus complète.
Cette dernière consiste à évaluer l’impact environnemental de la production et de l’utilisation d’un produit chimique en considérant toutes les étapes de la vie du produit : la provenance des réactifs, la synthèse et l’utilisation de substances auxiliaires, le transport, l’utilisation ainsi que le devenir dans l’environnement. C’est un travail complexe et coûteux. Et selon les composés chimiques étudiés, les informations peuvent être insuffisantes conduisant à des résultats parfois contradictoires. Cependant, en ce qui concerne les solvants - étant omniprésents en synthèse - les informations sont nombreuses pour que des analyses LCA soient réalisables et fiables.
- Un autre outil simple d’utilisation est le système dit « traffic light » de Pfizer
|
Préférables (verts) |
Utilisables (orange) |
Indésirable (rouge) |
|---|---|---|
|
Eau |
Cyclohexane |
Pentane |
| Acétone |
Heptane |
Hexane(s) |
| Ethanol | Toluène | Ether diisopropylique |
|
2-Propanol |
Méthylcyclohexane |
Ether diéthylique |
|
1-Propanol |
Méthyl t-butyl éther |
Dichlorométhane |
|
Acétate d’éthyle |
Isooctane |
1,2-Dichloroéthane |
|
Acétate d’isopropyle |
Acétonitrile |
N,N-Diméthylformamide |
| Méthanol |
2-Méthyl-THF |
N-Méthylpyrrolidin-2-one |
|
Méthyl éthyl cetone |
Tétrahydrofurane |
Pyridine |
|
1-Butanol |
Xylènes |
Diméthyl acetate |
|
t-Butanol |
Diméthyl sulfoxide |
1,4-Dioxane |
|
Acide acétique |
1,2-Diméthoxyéthane |
|
|
Ethylène glycol |
Benzène |
|
| Tétrachlorométhane |
Cette classification des solvants fut établie en appliquant des résultats similaires à ceux du système EHS à tous les solvants communément employés dans l’industrie pharmaceutique. Dans ce système, les solvants verts sont considérés comme ceux de moindre impact environnemental et sont préférables aux solvants oranges. Les solvants rouges sont ceux qui posent le plus de soucis d’ordre sanitaire et écologiques et doivent être évités. Le grand avantage d’un tel outil de sélection est qu’il ne requiert aucune connaissance spécifique en chimie verte d’où son utilisation fréquente.
Des solvants alternatifs
Des solvants alternatifs à ceux rencontrés « classiquement » en synthèse organique ont été proposés tels que l’eau, les liquides ioniques ou le CO2 supercritique (sc-CO2). Ils sont utilisés comme remplacement pour les traditionnels VOCs et consituent un domaine de recherche très actif.
Si les propriétés physiques de ces solvants et l’impact environnemental a priori moindre en font des solvants « verts », plusieurs critiques ont été formulées du fait de données insuffisantes pour pouvoir établir une analyse LCA complète ou même appliquer le système EHS. En réponse, Clark et Tavener [2], par le biais d'une analyse semi-quantitative, ont classé ces « nouveaux » solvants :
- le sc-CO2, l’eau et les solvants dérivés de sources renouvelables remportent les premières places de ce classement ;
- les liquides ioniques et les solvants fluorés les dernières.
Cependant, il faut garder à l'esprit que la simple possibilité de réaliser une réaction dans un de ces nouveaux solvants n’en fait pas automatiquement un solvant vert. C’est seulement par son utilisation commerciale au sein d’un procédé qu’un solvant ayant un impact environnemental moindre vis-à-vis d’une méthode antérieure peut être dit « vert ». A noter que l’impact environnemental global d’un procédé est déterminé par de nombreux facteurs comme l’efficacité de la réaction en termes d’économie atomique [3], de sélectivité, de production de déchet ou encore de consommation d’énergie.
Dans la suite, après un débat au sujet de l'eau (Solvants et chimie verte 2/3 : L'eau, solvant vert par excellence ?), nous développerons les propriétés et les applications de ces solvants alternatifs « verts » (Solvants et chimie verte 3/3 : Des solvants alternatifs « verts »).
Bibliographie et ressources en ligne
[1] Introduction à la chimie verte
[2] J.H. Clark , S.J. Tavener, Org. Process Res. Dev., 11, 149 (2007).
[3] Les concepts de la chimie verte : utilisation atomique et facteur E
[4] C. Reichardt, T. Welton, Solvents and Solvent Effects in Organic Chemistry, 4th Ed., Wiley-VCH.
[5] Solvants et chimie verte 2/3 : L'eau, solvant vert par excellence ?
[6] Solvants et chimie verte 3/3 : Des solvants alternatifs « verts »