Cet article fait partie d'un dossier sur la chromatographie en phase gazeuse (CPG). Il présente des exemples d'applications des analyses CPG. Avant de le lire, le lecteur est invité à prendre connaissance du premier article du dossier, traitant du principe, de l'appareillage et du déroulement d’une analyse CPG.
Méthode de l’étalon interne
La CPG est une méthode d’analyse quantitative, l’aire du pic Aicorrespondant à un analyte i du mélange à analyser étant proportionnelle à la masse mi d’analyte i injecté ; le coefficient de proportionnalité ki est appelé « coefficient de réponse », et dépend de l’espèce considérée et des conditions utilisées lors de l’analyse (colonne, température, débit du gaz vecteur, méthode, nature des composés, …) :
$$A_{i}= k_{i}m_{i}$$
Lorsqu’on cherche à déterminer la composition d’un mélange complexe, la grandeur mi dépend à la fois de la concentration molaire Ci en analyte i du mélange analysé, de la masse molaire Mi de cet analyte et du volume injecté Vinj :
$$m_{i}=C_{i}M_{i}V_{inj}=\frac{A_{i}}{k_{i}}$$
Pour déterminer Ci à partir de Ai, il est donc nécessaire de connaître le volume injecté avec précision, ce qui n’est pas toujours possible. La méthode de l’étalon interne permet de s’affranchir de la connaissance de cette grandeur.
L’« étalon interne » est une espèce chimique inerte qui est introduite en concentration connue cE dans le mélange à analyser. Théoriquement, la connaissance du coefficient de réponse de l’étalon interne, obtenu par étalonnage classique, donne donc un lien direct entre Vinj et AE.
$$m_{E}=C_{E}M_{E}V_{inj}=\frac{A_{E}}{k_{E}}$$ d'où $$V_{inj}=\frac{A_{E}}{k_{E}C_{E}M_{E}}$$
Cependant, en pratique, il n’est pas nécessaire de connaître kE, cE ou Vinj.
En effet, $$\frac{m_{i}}{m_{E}}=\frac{\frac{A_{i}}{k_{i}}}{\frac{A_{E}}{k_{E}}}=\frac{k_{E}}{k_{i}}\frac{A_{i}}{A_{E}}$$
Si toutes les analyses CPG sont effectuées dans les mêmes conditions, les valeurs de ki et kE sont les mêmes dans toutes les analyses. Ainsi, la valeur du rapport $\frac{k_{E}}{k_{i}}$ est la même pour tous les chromatogrammes et le rapport $\frac{m_{i}}{m_{E}}$ est donc proportionnel au rapport $\frac{A_{i}}{A_{E}}$.
Il suffit donc d’étudier les rapports $\frac{A_{i}}{A_{E}}$ et non simplement les aires Ai des pics des analytes. Le pic correspondant à l’étalon sert d’échelle, en quelque sorte.
D’après ce qui précède, il est donc essentiel qu’un étalon interne soit inerte, qu’il soit bien séparé des autres analytes du mélange sur le chromatogramme (pas de superposition entre son pic et celui d’un des analytes), mais avec un temps de rétention assez proche de ces analytes. De plus, l’aire du pic correspondant à l’étalon interne doit être du même ordre de grandeur que les aires des pics correspondant aux analytes.
Il est ainsi possible de doser par exemple l’éthanol d’alcools forts commerciaux, en utilisant le 4-méthylpentan-2-ol comme étalon interne [7]. Quatre mélanges étalons sont préparés et leur chromatogrammes sont acquis (colonne Carbowax®, détecteur FID).
|
|
Mélange 1 |
Mélange 2 |
Mélange 3 |
Mélange 4 |
Mélange à analyser |
|---|---|---|---|---|---|
|
Ethanol |
125 µL |
250 µL |
500 µL |
1000 µL |
1 mL rhum |
|
Etalon interne |
500 µL |
500 µL |
500 µL |
500 µL |
500 µL |
|
Eau |
qsp 100 mL |
||||
|
Aéthanol |
123767 V.s |
254535 V.s |
522948 V.s |
940367 V.s |
500172 V.s |
|
Aétalon interne |
900123 V.s |
925578 V.s |
968547 V.s |
863025 V.s |
943624 V.s |
|
Aéthanol/Aétalon interne |
0,123750 |
0,275001 |
0,539930 |
1,08962 |
0,530054 |
On remarque bien que les aires obtenues pour l’étalon interne sont effectivement sensiblement différentes, parce que le volume injecté n’est pas rigoureusement identique d’une analyse à l’autre. Les courbes de calibration obtenue avec et sans étalonnage montrent bien la supériorité de la méthode avec étalonnage interne (Figure 1).
Une solution contenant 1,000 mL d’un rhum à analyser, 500 µL d’étalon interne et dont le volume est ajusté à 100 mL est analysé par CPG. Les valeurs expérimentalement obtenues sont reproduites dans le tableau ci-dessus. D’après la courbe de calibration utilisant le rapport des aires de l’éthanol et de l’étalon interne, on en conclut que le mélange analysé contient 0,49 mL d’éthanol, d’où un degré alcoolique du rhum analysé de 49 %.
Suivi d’une réaction chimique
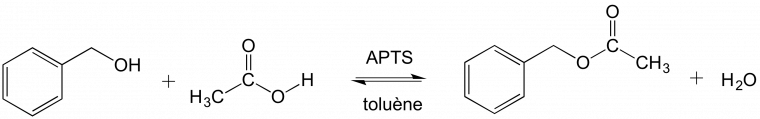
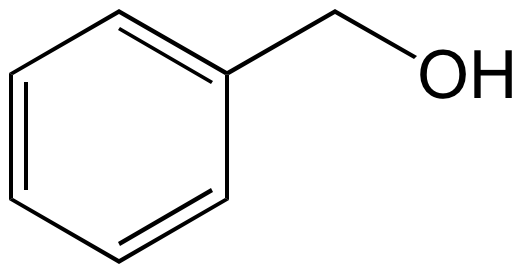
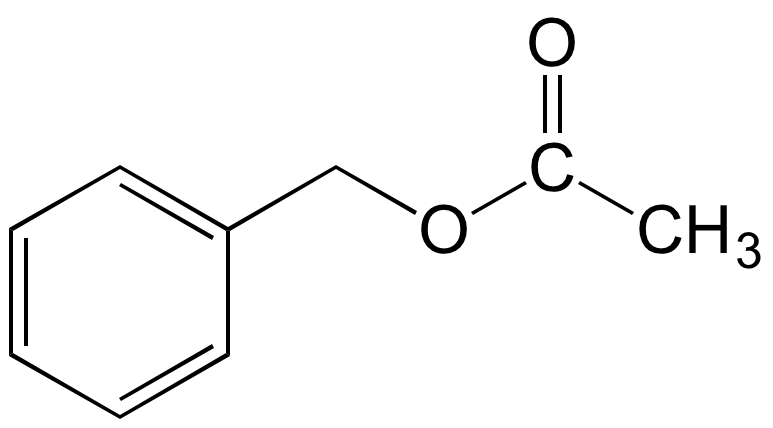
L’acétate de benzyle peut être synthétisé via une réaction d’estérification entre l’alcool benzylique et l’acide acétique (Figure 2).
Nous avons suivi le protocole proposé par l’ouvrage « Quarante expériences illustrées de chimie générale et organique : La chimie, une science expérimentale », de Elodie Martinand-Lurin et Raymond Grüber [8] qui utilise l’acide para-toluènesulfonique (APTS) comme catalyseur. Nous avons cependant choisi d’utiliser le toluène comme solvant et préféré utiliser un simple montage de chauffage à reflux plutôt qu’un montage de Dean–Stark, pour que le solvant du milieu réactionnel soit de composition constante.
En pratique, on introduit, dans un ballon monocol de 50 mL, 3,0 mL d'acide éthanoïque glacial, 5,0 mL d'alcool benzylique et 5 mL de toluène. On ajoute 100 mg d'acide para-toluènesulfonique et le mélange réactionnel est porté au reflux.
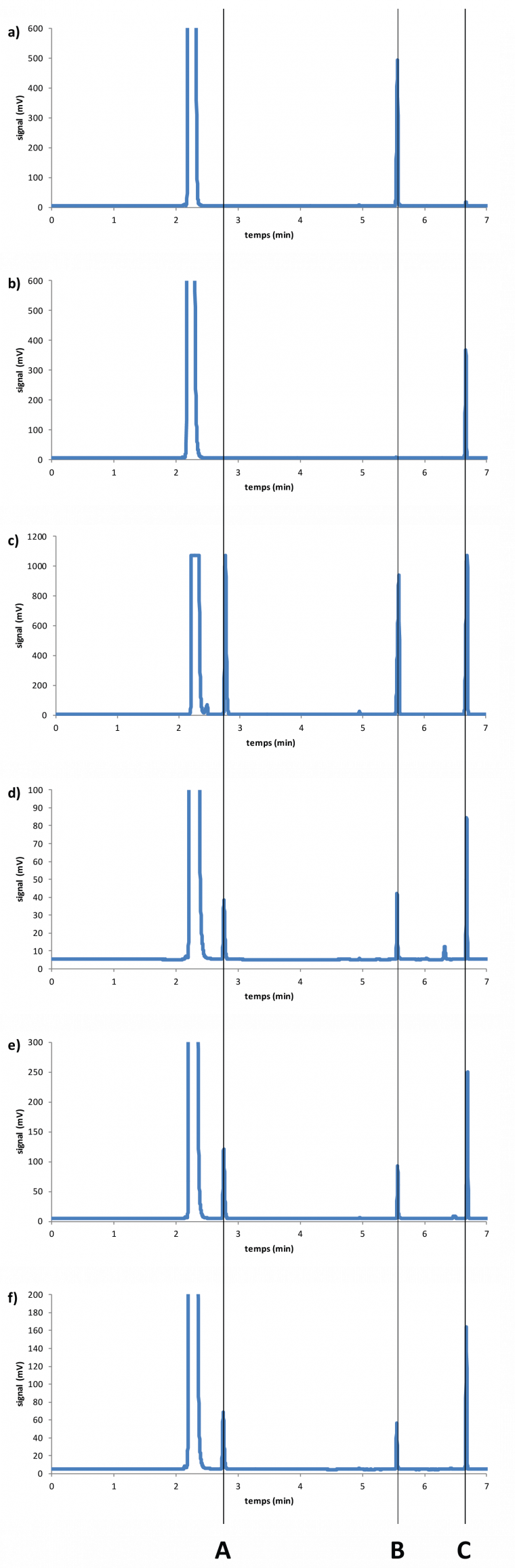
Un échantillon de brut réactionnel est prélevé aux dates t = 10 min, t = 20 min et t = 30 min (la date t = 0 correspondant au début du reflux). Cet échantillon est dilué 500 fois dans l’éther diéthylique, puis injecté dans le chromatographe, sur colonne apolaire ; l’analyse est conduite avec un gradient de température 50 – 250 °C sur 10 min. Les chromatogrammes obtenus sont rassemblés dans la Figure 3.
a) Solution d’alcool benzylique à 1 g.L–1 dans l’éther diéthylique ; b) Solution d’acétate de benzyle à 1 g.L–1 dans l’éther diéthylique ; c) Mélange réactionnel après 5 min de réaction ; d) Mélange réactionnel après 10 min de réaction ; e) Mélange réactionnel après 20 min de réaction ; f) Mélange réactionnel après 30 min de réaction.
La comparaison des chromatogrammes a, b, c, d et e permet d’identifier les analytes :
|
Nom des composés |
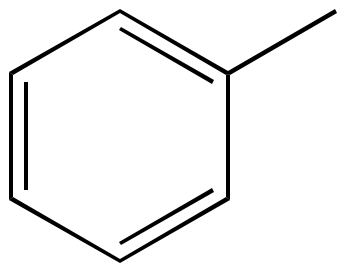
Toluène |
Alcool benzylique |
Acétate de benzyle |
|---|---|---|---|
|
Structure des composés |
|
|
|
|
Temps de rétention |
2,90 min |
5,60 min |
6,70 min |
|
Lettre sur le chromatogramme |
A |
B |
C |
Une première interprétation qualitative permet de voir l’avancement de la réaction. Le rapport de la hauteur du pic du produit (C) sur celui du réactif (B) augmente avec la durée de réaction.
On peut aller plus loin dans l’interprétation en utilisant les aires des pics dans les différents chromatogrammes.
|
Espèce calibrée |
Concentration injectée |
Aire du pic |
|---|---|---|
|
Alcool benzylique (B) |
1 g.L–1 |
612436 V.s |
|
Acétate de benzyle (C) |
1 g.L–1 |
360156 V.s |
Les calibrations permettent de retrouver les concentrations en alcool benzylique et en acétate de benzyle dans le milieu réactionnel aux différents temps de réaction. Cela suppose que les volumes injectés soient à peu près constants ; au vu de la précision nécessaire ici, une injection soignée suffit à s’en assurer, mais l’utilisation d’un étalon interne permettrait plus de précision. Connaissant la quantité de catalyseur (APTS) utilisé pour la réaction, on peut estimer la vitesse de réaction spécifique, c’est-à-dire le nombre de transformations que fait un cycle catalytique par unité de temps, selon la formule :
$$v_{s}=\frac{1}{[catalyseur]}\frac{\Delta[produit]}{\Delta t}$$
où [catalyseur] est la concentration en catalyseur introduite dans le milieu réactionnel et Δ[produit] est la variation de concentration en produit mesurée pendant la durée Δt.
|
Durée de réaction |
5 min |
10 min |
20 min |
30 min |
|
Aire du pic B (V.s) |
168673 |
102672 |
81994 |
72835 |
|
Concentration en B dans le milieu réactionnel (g.L-1) |
138 |
83,8 |
66,9 |
59,5 |
|
Aire du pic C (V.s) |
190374 |
229187 |
241347 |
246734 |
|
Concentration en C dans le milieu réactionnel (g.L-1) |
264 |
318 |
335 |
342 |
|
Vitesse de réaction spécifique (min-1) |
8,7 |
1,8 |
0,28 |
0,12 |
Notons que considérer le toluène comme étalon interne permettrait de s’affranchir des problèmes de précision lors de l’étape de dilution du milieu réactionnel.
Références et bibliographie (communes aux deux volets)
- Article Gas chromatography de l’encyclopédie collaborative en ligne Wikipédia.
- Principe d’analyse instrumentale, Skoog, Holler et Nieman (1ère édition française, traduite de la 5ème édition américaine).
- Modern Practice of Gas Chromatography, Grob, Robert L., Ed. John Wiley & Sons, 1977, p. 228.
- Site Airproducts
- Article de Jean-François Perrin sur le dosage de l'éthanol par CPG
- Quarante expériences illustrées de chimie générale et organique : La chimie, une science expérimentale, de Elodie Martinand-Lurin et Raymond Grüber, éditions de Boeck.
- Méthodes instrumentales d’analyse chimique et applications, 3ème édition, Gwenola Burgot, Jean-Louis Burgot, éditions LAVOISIER.