Parfois fonctionnels, parfois pathologiques, les amyloïdes sont des assemblages de protéines emmêlées difficiles à étudier.
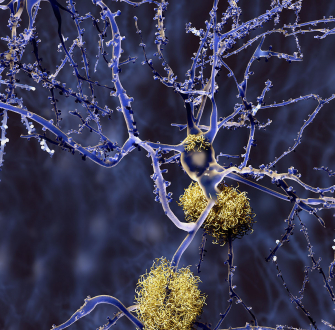
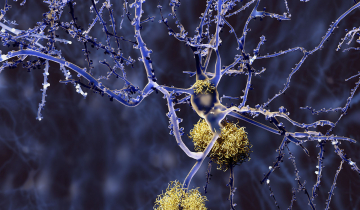
Les protéines s’assemblent parfois les unes aux autres, formant des plaques appelées des assemblages amyloïdes. Si ce phénomène naturel sert au bon fonctionnement des cellules, on le retrouve également dans les maladies neurodégénératives telles que celles de Parkinson, d'Alzheimer ou encore de Creutzfeldt-Jakob. Les différences entre les assemblages pathologiques et fonctionnels restent mal connues, à cause d’un manque de techniques disponibles pour en étudier finement la structure. Ces assemblages se présentent en effet sous des formes très hétérogènes, tout en étant composées de multiples copies emmêlées des mêmes segments de protéines, ce qui en complique l’observation. Des chercheurs de l’Institut de chimie et de biologie des membranes et des nanoobjets (CBMN, CNRS/Université de Bordeaux/Bordeaux INP), de l’Institut de biochimie et génétique cellulaires (IBGC, CNRS/U. Bordeaux), du Centre de RMN à très hauts champs de Lyon (CRMN, CNRS/UCBL/ENS Lyon) et de l’Institut Pasteur ont conçu une approche pour déterminer la structure des assemblages amyloïdes, à l’échelle atomique, grâce à la spectroscopie de résonance magnétique nucléaire (RMN) du solide.
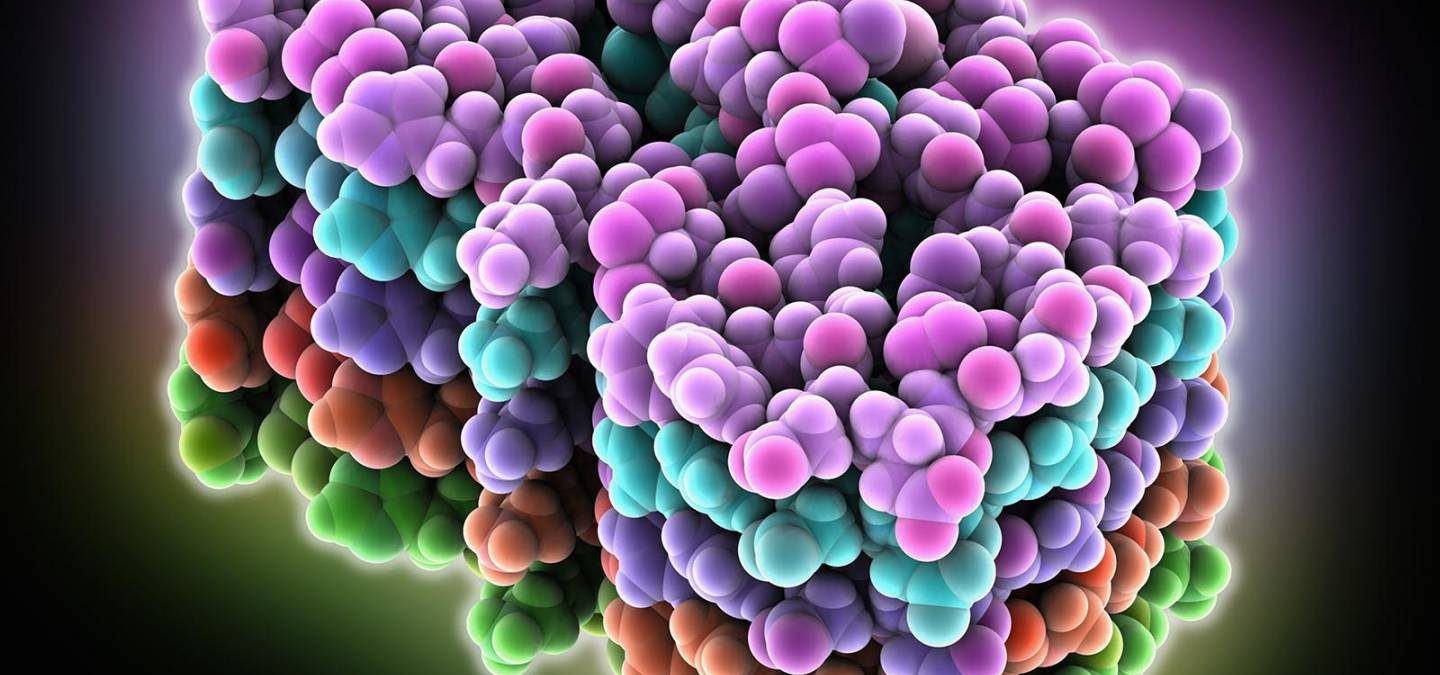
L’équipe a pour cela eu accès à des sondes de RMN développées récemment et encore très rares, grâce à l’Infrastructure de recherche IR-RMN du CNRS. Les scientifiques ont ensuite établi une méthodologie pour tirer le maximum de ces instruments de pointe, obtenant des mesures à partir de seulement quelques centaines de microgrammes d’échantillon. Ils ont ainsi déterminé la structure atomique et l’architecture supramoléculaire de l’assemblage amyloïde fonctionnel HELLF, un prion impliqué dans la mort cellulaire programmée de certains champignons. Grâce à cela, les chercheurs ont découvert quels mécanismes permettent aux protéines de former cet assemblage amyloïde. Forts de ces premiers résultats, ils appliquent à présent leur méthodologie à l’étude d’autres assemblages amyloïdes, y compris ceux retrouvés dans des pathologies neurodégénératives.