Cet article en deux volets présente une nouvelle voie de recherche en chimie médicinale pour le traitement de la maladie d'Alzheimer, pathologie neuro-dégénérative affectant près d'un million de personnes en France.
Le premier volet de cet article (ci-dessous) traite du rôle du cuivre dans la maladie d'Alzheimer et présente des molécules conçues pour réguler sa concentration au sein de l'organisme d'un malade. Le second volet expose le principe de ce traitement et les résultats très encourageants obtenus avec ces molécules.
La maladie d'Alzheimer : un défi majeur en chimie médicinale
Environ 35 millions de personnes dans le monde (près d'un million en France) souffrent actuellement de la maladie d'Alzheimer (MA), pathologie neurodégénérative qui se traduit par une perte progressive et irréversible des fonctions cognitives et du langage, et des modifications profondes de la personnalité conduisant à une dépendance totale des malades. Dans une faible proportion des cas, la maladie a une origine génétique et familiale, et apparaît précocement. Dans la majeure partie des cas (> 98 %), la maladie est sporadique, développée à un âge avancé, et liée aux multiples causes et paramètres du vieillissement. Son incidence augmente donc fortement avec l'espérance de vie, et l'on estime que le nombre de malades pourrait atteindre 100 millions en 2050 [1]. Les mécanismes biochimiques de cette maladie neurodégénérative sont complexes et loin d'être totalement élucidés.
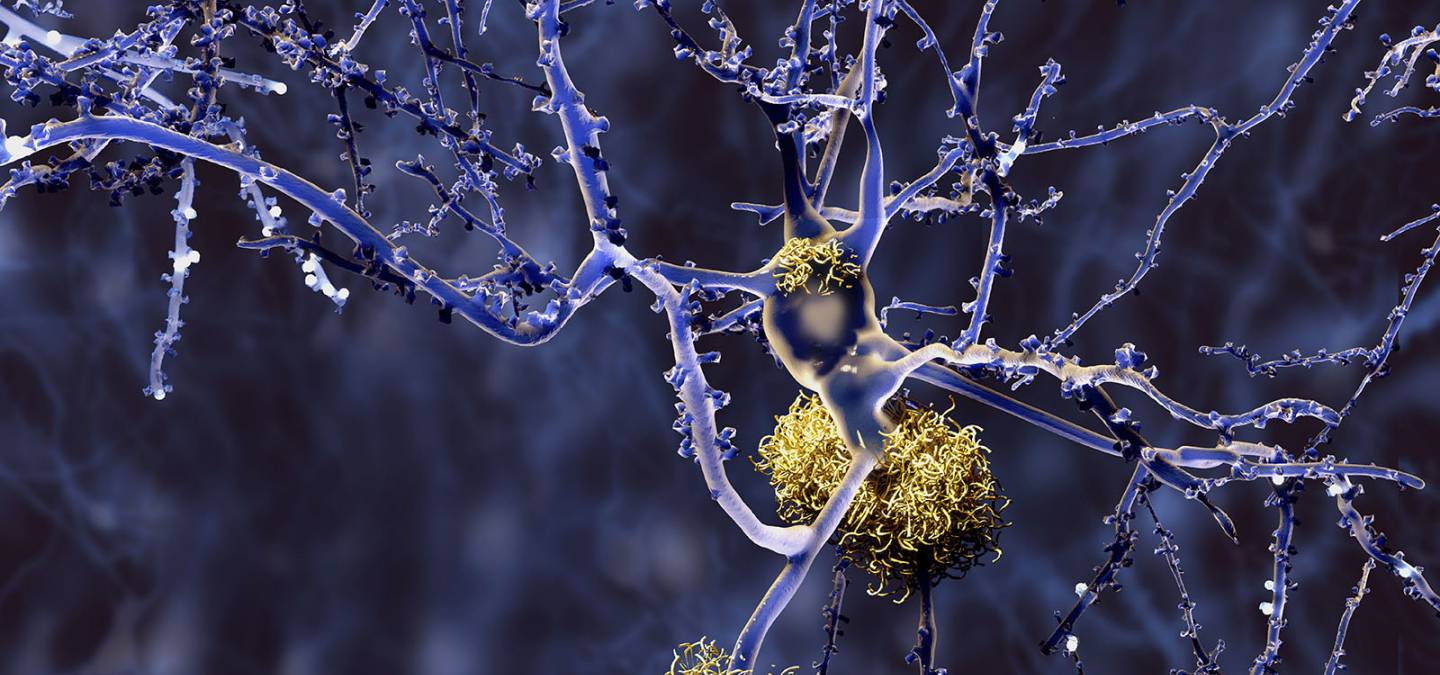
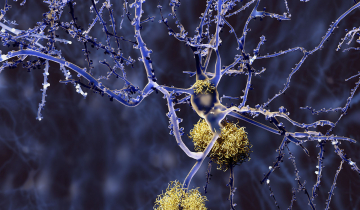
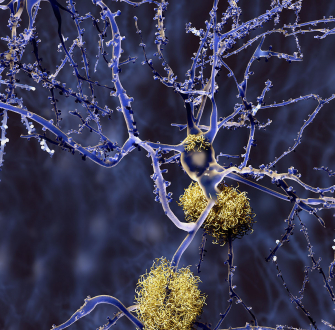
Les plaques séniles (Figure 1), constituées de peptide b-amyloïde1 agrégé, et les neurofibrilles de protéine tau phosphorylée sont deux types de lésions identifiées lors de l'examen post mortem du cerveau des patients atteints de MA. Ces phénomènes pathologiques ont donc été considérés comme des cibles potentielles de médicaments [2,3]. Mais, malgré des efforts et des financements considérables depuis une vingtaine d'années, tant de la recherche académique que de l'industrie pharmaceutique, il n'y a actuellement aucun médicament efficace contre la MA, et les essais cliniques sont infructueux [4]. Il faut donc rechercher d'autres cibles thérapeutiques afin de mettre au point des médicaments capables d’inhiber l’évolution de la MA dès les stades précoces, c’est-à-dire avant la formation importante de déficits neurologiques irréversibles. C'est l’un des défis majeurs de la chimie médicinale actuelle.
Le cuivre dans la maladie d'Alzheimer
L'examen des plaques amyloïdes montre que la concentration en cuivre de celles-ci est environ 6 fois plus élevée que la moyenne d'un cerveau sain (il y a davantage de fer aussi, d'ailleurs, mais c'est une autre histoire...). Avec d’autres facteurs, la défaillance de l’homéostasie1 (c’est-à-dire la régulation) du cuivre dans le cerveau des patients est susceptible de produire un « stress oxydant » délétère, responsable de la destruction des neurones et de l'état inflammatoire du cerveau des patients.
Réduction de l'oxygène par un métal de transition de bas degré d'oxydation : le stress oxydant
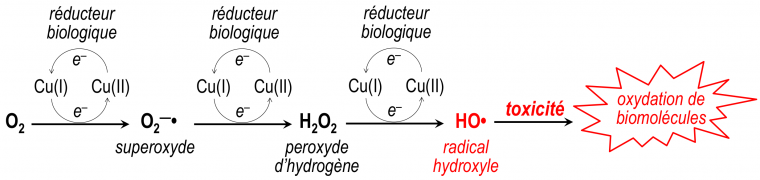
Tous les organismes aérobies2, sont confrontés à une difficulté majeure : la nécessité vitale du dioxygène et le caractère potentiellement toxique de cette molécule lorsque sa réactivité échappe à un strict contrôle physiologique. En effet, la réduction complète du dioxygène (mettant en jeu 4 électrons et produisant de l'eau, selon la demi-équation O2 + 4 H+ + 4 e- = 2 H2O) n'a pas lieu en une seule étape.
La réduction partielle, électron par électron, produit des espèces réduites, réactives, de l'oxygène (Figure 2) ; ces espèces partiellement réduites sont appelées Reactives Oxygen Species ou ROS en anglais.
La toxicité propre de l’anion superoxyde O2–• et du peroxyde d’hydrogène H2O2 sont faibles parce qu'il existe des enzymes qui régulent leurs concentrations (superoxyde dismutases pour O2–• et catalase pour H2O2) ; en revanche, le radical hydroxyle HO•, produit de la réduction à trois électrons de O2, est toxique à faible concentration pour les cellules, du fait de sa forte réactivité quel que soit le substrat, et de l'absence d'enzyme spécifique de détoxification.1 Cette réduction du dioxygène peut être effectuée par des métaux endogènes2 ayant une activité oxydo-réductrice, tels que le fer3 et le cuivre, lorsque, du fait d'une situation pathologique, leur réactivité échappe à un contrôle physiologique normal. Dans un milieu intracellulaire réducteur, cette production catalytique extrêmement efficace de radicaux hydroxyle HO• conduit à la mort cellulaire. C'est ce que l'on appelle le « stress oxydant » ; c'est l'un des éléments des processus qualifiés médicalement d'inflammatoires.
Toxicité des complexes Cu-Aβ
L'homéostasie du cuivre est perturbée dans le cerveau des patients atteints de MA. Une quantité anormale de ce métal est stocké dans les plaques amyloïdes et la production de radicaux HO•, catalysée par le cycle redox Cu(I)/Cu(II) « incontrôlé », conduit à la mort des neurones. Ce processus entraîne une consommation excessive de réducteurs physiologiques, ce qui accentue le stress oxydant généré. De plus, la séquestration du cuivre dans les complexes Cu-amyloïdes induit un défaut de ce métal dans d'autres compartiments cérébraux4 [5]. La restauration de l'homéostasie du cuivre est donc une cible pharmacologique potentielle.
Restauration de l'homéostasie du cuivre : une voie thérapeutique
Le défi consiste à mettre au point des chélateurs capables d'extraire le cuivre piégé dans les amyloïdes pour le remettre à la disposition des protéines (enzymes et transporteurs) contenant normalement du cuivre, et de réduire ainsi le stress oxydant induit par les complexes Cu-amyloïdes. De plus, pour envisager d'en faire des médicaments, ces chélateurs doivent être :
- capables de passer la barrière hémato-encéphalique après une administration orale,
- spécifiques pour le cuivre,
- sans effet sur l'activité des enzymes ou protéines à cuivre physiologiques [6].
Conception de ligands spécifiques
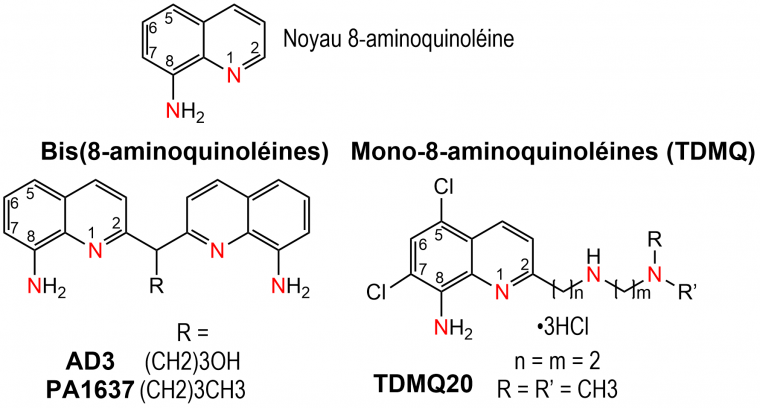
Nous avons conçu des molécules possédant un squelette 8-aminoquinoléine (Figure 3).
La série initiale, constituée de bis(8-aminoquinoléines), offre au cuivre une coordination tétradentate par 4 atomes d’azote (N4) : deux atomes d'azote intracycliques et deux provenant des groupes C8-amino (Figure 3). Dans le but d'améliorer la solubilité et les propriétés thérapeutiques de ces chélateurs du cuivre, une seconde série de molécules dites TDMQ (pour « TetraDentate MonoQuinolines ») a été mise au point. Les TDMQ sont constituées d'un squelette 8-aminoquinoléine (2 atomes d'azote coordinants) et d'une chaîne latérale variable comportant deux sites chélateurs supplémentaires (Figure 3).
Ces ligands ont une très forte affinité pour le Cu(II), avec des constantes d'affinité apparentes de 14 à 16 à pH physiologique (en valeur logarithmique, Tableau 1) [7,9].
| Métal | |||||
|---|---|---|---|---|---|
| Cu(II) | Zn(II) | ||||
| Ligand L | sphère de coordination |
log (Kaff) à pH = 7,4 |
sphère de coordination |
log (Kaff) à pH = 7,4 |
sélectivité Cu/Zn |
| TDMQ20 | (A) N4(Cl) | 16,5 | N2Cl2 | 4,2 | 12,3 |
| (B) N4(OH2) | |||||
| TDMQ22 | N4(Cl2) | 15,1 |
non déterminée |
4,6 | 10,5 |
| TDMQ37 | N4(Cl) | 17,1 | N2Cl2 | 5,2 | 11,9 |
| AD3 | N4(Cl) | 16,5 | - | < 4,0 | > 12,5 |
| PA1637 | N4 | 16,7 | - | < 4,0 | > 12,5 |
Leur sélectivité pour le cuivre par rapport au zinc est également très forte, puisque l'affinité pour Cu(II) est de 10 à 12 ordres de grandeur plus élevée que l'affinité pour Zn(II) [8]. Cette sélectivité est un critère important dans la mesure où le cerveau est un organe riche en Zn(II), qui joue un rôle important dans le fonctionnement des synapses.
Mode d'action de ces ligands
In vitro, à faible concentration, ces chélateurs L extraient immédiatement et totalement le Cu(II) complexé par un peptide amyloïde pour donner le complexe CuII–L [10]. Par une suite de réactions, le Cu(II) est ensuite transféré au glutathion, puis à d'autres protéines de l'organisme fonctionnant avec ce métal, afin de restaurer l'homéostasie du cuivre.
Bibliographie commune aux deux volets
- World Alzheimer Report 2015. The global impact of dementia – An Analysis of prevalence, incidence, cost and trends. https://www.alz.co.uk/research/WorldAlzheimerReport2015.pdf ; Disponible, 20 juillet 2020.
- D. J. Selkoe, J. Hardy. The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO Mol. Med. 2016, 8, 595-608.
- Tomiyama, T.; Matsuyama, S.; Iso, H.; Umeda, T.; Takuma, H.; Ohnishi, K.; Ishibashi, K.; Teraoka, R.; Sakama, N.; Yamashita, T.; Nishitsuji, K.; Ito, K.; Shimada, H.; Lambert, M. P.; Klein, W. L.; Mori, H. A mouse model of amyloid β oligomers: Their contribution to synaptic alteration, abnormal tau phosphorylation, glial activation and neuronal loss in vivo. J. Neurosc. 2010, 30, 4845-4856.
- Cummings, J. L.; Travis, M.; Zhong, K. Alzheimer’s disease drug-development pipeline: few candidates, frequent failures. Alzheimer’s Res. Ther. 2014, 6, 37-43.
- Bayer, T. A.; Schäfer, S.; Simons, A.; Kemmling, A.; Kamer, T.; Tepest, R.; Eckert, A.; Schüssel, K.; Eikenberg, O.; Sturchler-Pierrat, C.; Abramowski, D.; Staufenbiel, M.; Multhaup, G. Dietary Cu stabilizes brain superoxide dismutase 1 activity and reduces Aβ production in APP23 transgenic mice. Proc. Natl. Acad. Sci. USA 2003, 100, 14187-14192.
- Liu, Y.; Nguyen, M.; Robert, A.; Meunier, B. Metal ions in Alzheimer’s disease: A key role or not? Acc. Chem. Res. 2019, 52, 2026-2035.
Acc. Chem. Res. 2015, 48, 1332-1339. Nguyen, M.; Robert, A.; Sournia-Saquet, A.; Vendier, L.; Meunier, B. Characterization of new specific copper chelators as potential drugs for the treatment of Alzheimer’s disease. Chem. Eur. J. 2014, 20, 6771–6785. Nguyen, M.; Bijani, C.; Martins, N.; Meunier, B.; Robert, A. Transfer of copper from an amyloid to a natural copper-carrier peptide with a specific mediating ligand. Chem. Eur. J. 2015, 21, 17085-17090. Nguyen, M. ; Robert, A.; Sournia-Saquet, A.; Vendier, L.; Meunier, B. The necessity of having a tetradentate ligand to extract copper(II) ions from amyloids. ChemistryOpen 2015, 4, 27-31. Zhang, W.; Huang, D.; Huang, M.; Huang, J.; Wang, D.; Liu, X.; Nguyen, M.; Vendier, L.; Mazères, S.; Robert, A.; Liu, Y.; Meunier, B. Preparation of new tetradentate copper chelators as potential anti-Alzheimer agents. ChemMedChem 2018, 13, 684-704. Zhang, W.; Liu, Y.; Hureau, C.; Robert, A.; Meunier, B. N4-Tetradentate chelators efficiently regulate copper homeostasis and prevent ROS production induced by copper-amyloid-beta-1-16, even in the presence of an excess of zinc. Chem. Eur. J. 2018, 24, 7825-7829. https://www.prnewswire.com/news-releases/prana-biotechnology-announces-preliminary-results-of-phase-2-imagine-trial-of-pbt2-in-alzheimers-disease-253173581.html. Prana Biotech, Communiqué de presse du 31 mars 2014. Disponible, 21 juillet 2020. Cherny, R. A.; Atwood, C. S.; Xilinas, M. E.; Gray, D. N.; Jones, W. D.; McLean, C. A.; Barnham, K. J.; Volitakis, I.; Fraser, F. W.; Kim, Y.-S.; Huang, X.; Goldstein, L. E.; Moir, R. D.; Lim, J. T.; Beyreuther, K.; Zheng, H.; Tanzi, R. E.; Masters, C. L.; Bush, A. I. Treatment with a copper-zinc chelator markedly and rapidly inhibits beta-amyloid accumulation in Alzheimer's disease transgenic mice. Neuron 2001, 30, 665-676. Andersson, D. A.; Gentry, C.; Moss, S.; Bevan, S. Clioquinol and pyrithione activate TRPA1 by increasing intracellular Zn2+. Proc. Natl. Acad. Sci. USA 2009, 109, 8374-8379. Nguyen, M. ; Vendier, L. ; Stigliani, J.-L. ; Meunier, B. ; Robert, A. Structures of copper and zinc complexes of PBT2, a chelating agent evaluated as potential drug for neurodegenerative diseases. Eur. J. Inorg. Chem. 2017, 600-608. Ceccom, J.; Coslédan, F.; Halley, H.; Francès, B.; Lassalle, J.-M.; Meunier, B. Copper chelator induced efficient episodic memory recovery in a non-transgenic Alzheimer's mouse model. PloS One 2012, 7, 43105. - Huang, J.; Nguyen, M.; Liu, Y.; Robert, A.; Meunier, B. The TDMQ regulators of copper homeostasis do not disturb Cu,Zn-SOD and tyrosinase activity, nor the Cu(III) cofactor vitamin B12. Eur. J. Inorg. Chem. 2019, 1384-1388.