Article en deux volets traitant du dioxyde de titane, de ses procédés de synthèse (premier volet) à ses applications en photocatalyse (second volet, ci-dessous).
Les propriétés de « photo-catalyseur » du dioxyde de titane sont liées à son caractère semi-conducteur. Avant d’étudier le fonctionnement de ce semi-conducteur photo-activé, quelques rappels sur les isolants, semi-conducteurs et conducteurs sont fournis.
Isolants, semi-conducteurs et conducteurs
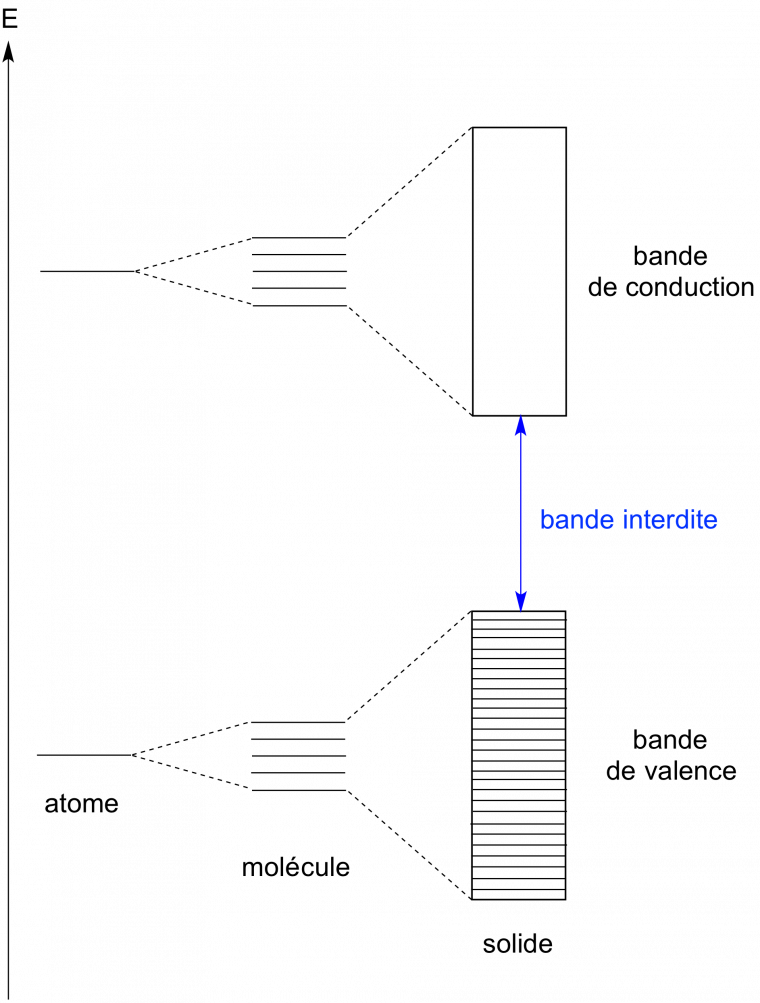
Rappelons l’évolution du diagramme d’énergie lors qu’on passe d’un atome à une molécule puis à un solide Figure 1 :
On observe des niveaux discrets d’énergie au sein d’un atome ou d’une molécule; au sein du solide, les niveaux d’énergie sont très proches, ce qui conduit à l’apparition de bandes d’énergie: une bande de valence (niveaux remplis d’électrons) et une bande de conduction (niveaux vides à 0 K).
La qualification d’un matériau d’isolant, de semi-conducteur ou de conducteur repose sur une étude approfondie de ses propriétés électriques. Par cela, nous entendons le comportement d’un matériau suite à l’application d’un champ électrique extérieur. Une telle réponse dépend d’une propriété intrinsèque majeure du matériau: la bande interdite (bandgap en anglais). Cette dernière constitue la séparation entre la bande de valence et la bande de conduction.
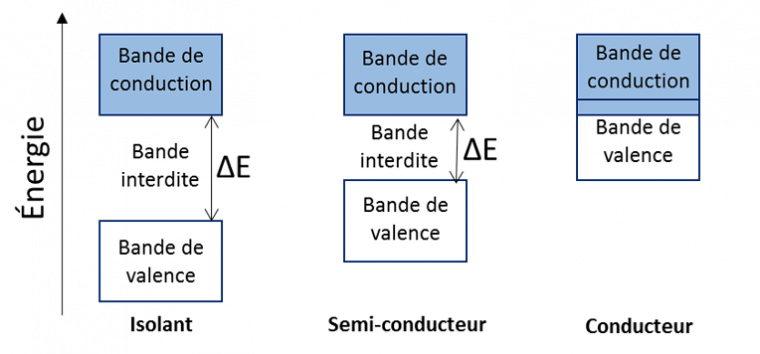
Les électrons se trouvent initialement dans la bande de valence et la capacité conductrice du matériau est conditionnée par la facilité de transit de ces électrons vers la bande de conduction (Figure 2). Pour les conducteurs, la bande de conduction et la bande de valence se chevauchent : les électrons transitent instantanément entre les deux bandes et peuvent circuler dans le solide : la conductivité est bonne. Plus la bande interdite est large, plus le matériau acquiert un caractère isolant (bande interdite de l’ordre de 5 - 6 eV). Dans le cas d’un semi-conducteur, la bande interdite est plus faible que celle d’un isolant (entre 0,5 et 4 eV) : considéré isolant au départ, il peut devenir conducteur si une énergie suffisante est apportée (sous forme de chaleur, de rayonnement…) pour faire passer des électrons de la bande de valence à la bande de conduction.
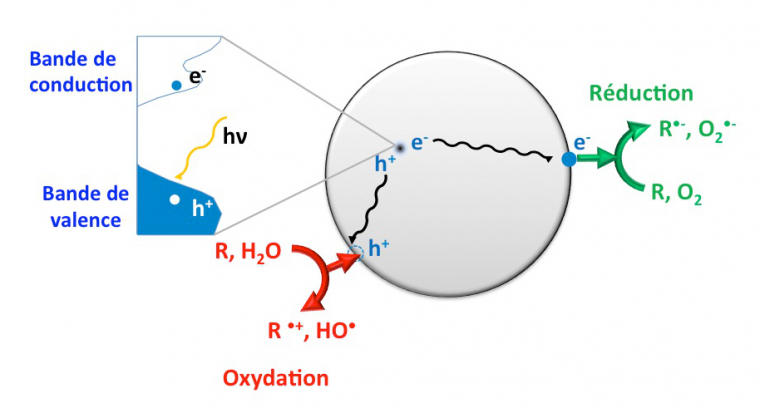
Un semi-conducteur photo-activé doit absorber un rayonnement d’énergie au moins équivalente à sa bande interdite afin de provoquer le passage d’un électron de la bande de valence vers la bande de conduction. Cela entraîne la formation d’un trou à la place de l’électron dans la bande de valence : une paire électron/trou est créée. Ces porteurs de charge peuvent se déplacer au sein du semi-conducteur et participer à une réaction chimique. Ils peuvent aussi se recombiner : plus la recombinaison est tardive, plus la paire électron/trou a une durée de vie longue et plus le semi-conducteur est actif.
Le dioxyde de titane, un semi-conducteur photo-activé
Le dioxyde de titane est un semi-conducteur à large bandgap car la bande interdite de la structure anatase est estimée à 3,2 eV. Ceci qui est cohérent avec le fait que ce matériau est un bon absorbant dans le domaine du rayonnement ultra-violet et donc qu’il présente une couleur blanche.
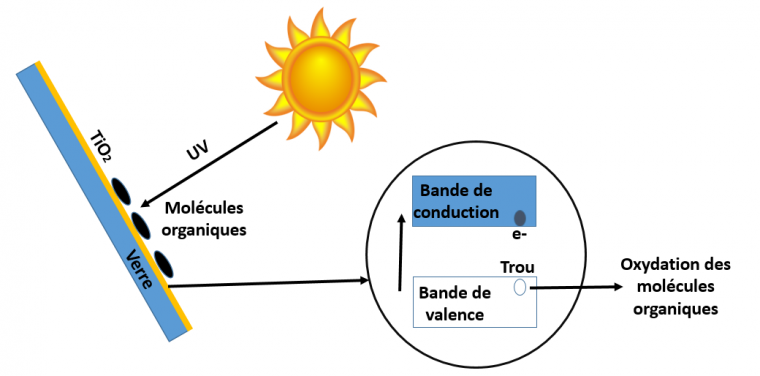
Après la photo-activation du dioxyde de titane par les rayonnements UV du soleil conduit à la formation des paires électron/trou mentionnées précédemment TiO2 → TiO2 (h+BV + e−BC)
(h+ désigne le trou et e− désigne l’électron ; BV et BC désignent respectivement les bandes de valence et de conduction).
Les trous formés dans la bande de valence qui ont migré à la surface peuvent être impliqués dans une réaction d’oxydation, alors que les électrons passés dans la bande de conduction peuvent servir à des réductions. Ainsi, des réactions d’oxydoréduction peuvent avoir lieu à la surface du semi-conducteur. On parle alors de photo-catalyse.
Le principe général de la photocatalyse est illustré Figure 3.
Toutes les formes cristallines du TiO2 ne sont pas également efficaces en photo-catalyse ; la variété anatase semble l’être plus que les autres. Son efficacité dans la catalyse de la dégradation des molécules organiques par irradiation des UV solaires en a fait l’un des constituants-clés des matériaux autonettoyants tels que les verres autonettoyants (en anglais Self-cleaning glass), utilisés notamment pour les grandes surfaces de verre dans les gratte-ciels. Ces propriétés sont également mises à profit dans le domaine de la dépollution. Il peut être utilisé sous la forme d’un film déposé sur un support solide ou bien sous la forme d’une poudre en suspension. Dans le cas des verres autonettoyants, des films nanométriques durs de TiO2 sont déposés à la surface des verres ; l’objectif est la dégradation par oxydation des molécules organiques qui se déposent à la surface du verre. Idéalement une minéralisation complète, c’est-à-dire une transformation en dioxyde de carbone et eau, est visée. A défaut, la dégradation doit former des molécules plus petites et moins adhésives. En effet, il se trouve que le dioxyde de titane photo-activé est en outre superhydrophile, autre propriété nécessaire pour la conception d’un verre autonettoyant. L’eau de pluie forme alors un film à la surface du verre (et non plus des gouttes) et les résidus des réactions de dégradation sont balayés par gravité.
La Figure 4 est une représentation schématique du mécanisme de dégradation de molécules organiques par TiO2. La dégradation des polluants organiques peut être directe ou médiée par la formation de radicaux en présence d’eau ou de dioxygène.
Les réactions se produisant au cours de la photo-catalyse sont alors :
Formation d’une paire électron-trou (h+ désigne le trou) : TiO2 → TiO2 (h+ + e–) (1)
Réduction du dioxygène, générant l’anion superoxyde •O2− : e− + O2 → •O2− (2)
Autoprotolyse de l’eau : H2O ⇄ H+ + OH– (3)
Formation du radical hydroxyle HO• très oxydant : OH– + h+ → HO• (4)
L’anion superoxyde peut lui aussi générer des radicaux HO• via la suite d’étapes ci-dessous :
•O2−+H+ → HOO• (5)
2 HOO• → H2O2 + O2 (6)
H2O2 → 2 HO• (7)
H2O2 + e− → OH− + HO• (8)
Les radicaux HO• très oxydants peuvent conduire à la dégradation d’une molécule organique, notée RH, selon la suite d’étapes ci-dessous :
HO• + RH → R• + H2O (9)
R• + HO• → ROH (10)
R-OH + HO• → R’-CHO → R’-COOH (11)
R’-COOH + h+ → R’-COO• + H+ → R’• + CO2(g) (12)*
R’• + HO• → R’OH → R’’-CHO → R’’-COOH → etc. (13)
*On peut également observer des transferts directs d’h+ selon une réaction dite de photo-Kolbe, qui, pour l’acide formique (plus exactement sa base conjuguée), a pour équation :
HCOO− + h+ → CO2(g) + H•
La poursuite de ces réactions conduit à une minéralisation totale.
Il faut noter que, une fois la paire (électron-trou) créée, la recombinaison trou-électron peut avoir lieu : TiO2 (h+BV + e−BC) → TiO2
Cette réaction est très rapide, de l’ordre de la picoseconde. Elle peut s’effectuer de façon radiative ou non radiative mais n’est évidemment pas souhaitée dans le cadre de la photocatalyse.
Si les propriétés photo-catalytiques du dioxyde de titane sont utilisées dans les verres autonettoyants depuis une quinzaine d’années, elles trouvent également des applications dans l’industrie textile (fabrication de vêtements autonettoyants impliquant l’élimination de colorants, graisses, odeurs, bactéries, virus…) et dans le secteur de la dépollution (oxydation des composés organiques volatils (COV) notamment).
Les propriétés photo-catalytiques du TiO2 peuvent néanmoins avoir un impact négatif lorsqu’il est utilisé comme pigment dans les peintures. En effet, l’exposition prolongée au soleil active le dioxyde de titane qui peut alors oxyder les molécules organiques de la peinture elle-même et causer son effritement. Les artistes des années 1920 à 1940, qui utilisaient le dioxyde de titane sous forme anatase dans leurs peintures, observaient ce phénomène de craquellement de la peinture suite à son exposition au soleil, phénomène qu’ils appelaient « farinage ». C’est la raison pour laquelle, à partir des années 1940, c’est la forme rutile du dioxyde de titane, moins active en photo-catalyse, qui est incorporée dans les peintures. Actuellement, on recouvre même le dioxyde de titane d’une fine couche d’alumine ou de silice pour éviter tout contact avec l’air et l’eau.
Amélioration des propriétés photo-catalytiques de TiO2 par dopage
Les chercheurs mettent à profit les propriétés photo-catalytiques du dioxyde de titane en l’intégrant à des systèmes de production d’énergie, notamment dans les cellules photo-électrochimiques. Les recherches avaient commencé avec Fujishima et Honda qui avaient mis au point en 1972 la première cellule photo-électrochimique réalisant la photo-électrolyse de l’eau à la surface du TiO2 irradié par les UV. Contrairement à la cellule photovoltaïque qui convertit l’énergie solaire directement en énergie électrique qui doit être utilisée immédiatement, la photo-électrolyse de l’eau utilise le rayonnement solaire pour produire de manière propre du dihydrogène utilisable plus tard dans des piles à combustibles. Les réactions impliquées dans la photo-électrolyse de l’eau ne nécessitent pas des valeurs de bandes interdites très élevées: 2 eV sont largement suffisants pour réaliser cette opération.
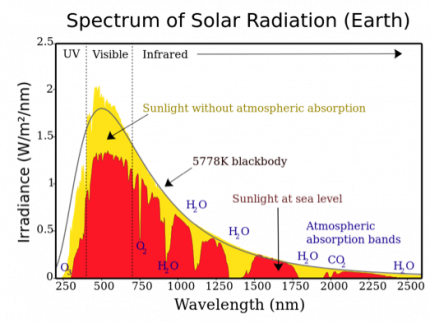
L’obtention des propriétés photo-catalytiques du dioxyde de titane nécessite de travailler dans le proche UV (UV-A, 300 nm < λ < 400 nm), du fait d’une bande interdite de 3,2 eV. Or les UV constituent une faible partie du spectre solaire (Figure 5).
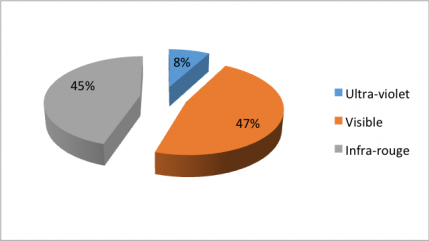
On remarque en effet la présence d’un maximum de radiation solaire aux alentours de 500 nm et le fait qu’une partie importante du spectre solaire est composée de lumière visible. Les pourcentages des domaines composant le spectre solaire sont présentés dans la Figure 6. Ceci explique la limitation de l’utilisation du TiO2 dans le domaine des cellules solaires parce qu’il est efficace essentiellement dans le domaine des UV, minoritaire dans le spectre solaire.
Pour améliorer l’efficacité du dioxyde de titane en photocatalyse, plusieurs méthodes ont été mises au point. Parmi celles-ci, la technique la plus connue est le « dopage ». Un matériau est dopé lorsqu’un élément étranger est introduit au sein de sa maille.
Les objectifs du dopage pour l’amélioration des propriétés photocatalytiques du dioxyde de titane sont:
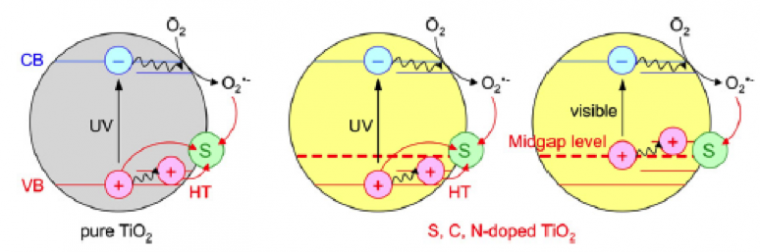
- soit de diminuer la séparation bande de valence/bande de conduction en créant des niveaux dans la bande interdite (Figure 7) : le chemin à parcourir par l’électron devient alors plus court et il est possible de travailler dans le domaine visible ;
- soit d’augmenter la durée de vie d’une paire électron/trou. Par cela, nous entendons séparer l’électron et le trou sur une durée plus longue, donc donner lieu à plus de réactions d’oxydation.
Lors du dopage à l’azote, un niveau d’énergie est créé au sein de la bande interdite, ce qui permet de travailler dans le visible.
Au cours de la première partie de ma thèse, j’ai mis au point une préparation de dioxyde de titane dopé à l’azote par Plasma Enhanced Chemical Vapor Deposition. C’est une technique dans laquelle un précurseur organique comme l’isopropoxyde de titane Ti(Pr)4 est fragmenté sous oxygène dans un gaz ionisé afin de développer une couche mince de TiO2 (sous forme anatase) à la surface du substrat. L’élément dopant (l’azote) est introduit également sous forme de gaz dans l’enceinte. Dans ce matériau dopé, la bande interdite initiale de l’anatase (3,2 eV) est réduite vers une valeur voisine de 2,8 eV, ce qui constitue un progrès pour l’application du TiO2 dans le domaine solaire.
Conclusion
En conclusion, le dioxyde de titane est une céramique semi-conductrice peu onéreuse, absorbant les UV, abondante et inerte chimiquement. Elle existe sous différentes formes cristallines dont les propriétés différentes permettent des applications variées: peintures et crèmes solaires pour la variété rutile, matériaux autonettoyants et dépollution via la photo-catalyse pour la forme anatase. Elle rentre actuellement dans l’industrie des verres autonettoyants à grande échelle. A l’avenir, les propriétés photo-catalytiques du TiO2 doivent être optimisées afin de répondre sous lumière visible, ce qui permettrait son intégration dans le domaine des cellules photo-électrochimiques (de nouvelles cellules originales sont en cours de fabrication dans le cadre de mon projet de thèse).
Bibliographie (commune aux deux volets)
- Physique des semi-conducteurs, A.Chovet et P.Masson (2004-2005)-Ecole Polytechnique Universitaire de Marseille (Dept. de Micro-électronique et Télécommunications), 1-75.
- Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications and Applications, Xiaobo Chen and Samuel S. Mao (2007), Chem. Rev. (107) 2891-2959.
- Clefs du CEA n° 50/51, hiver 2004-2005.
- Thèse de Loraine Youssef, Développement par procédé plasma de couches minces de type TiO2 dopé à l'azote pour la production d 'hydrogène par photo-électrolyse de l 'eau sous lumière solaire, (2015-2018).
- http://hmf.enseeiht.fr/travaux/bei/beiere/content/2012-g01/les-procedes-doxydation-avancee#TiO2 /UV
- Les textiles photocatalytiques, Jean-Marie HERMANN, Actualité Chimique février-mars 2012.
- Le verre autonettoyant, Léthicia Guéneau-Rancurel, Actualité Chimique septembre 2007.
- Thèse de Laure PERUCHON, Caractérisations des propriétés photocatalytiques des verres autonettoyants – corrélation entre paramètres physico-chimiques et activité photocatalytique, 2007, https://tel.archives-ouvertes.fr/tel-00453175
- A surface science perspective on TiO2 photocatalysis, Michael A Henderson, Surface Science Reports, 2011.
- Données sur le dioxyde de titane de la Société Chimique de France
- Références des clichés obtenus par microscopie électronique à balayage (Figure 5 du premier volet):
- nanotubes : Thèse Selima Benkara, Étude des propriétés électroniques et photoniques des couches minces à base d'oxydes nanostructurés, 2014.
- nanoparticules : Visible Light Irradiation-Mediated Drug Elution Activity of Nitrogen-Doped TiO2 Nanotubes, Seunghan Oh, Kyung-Suk Moon, Joo-Hee Moon, Ji-Myung Bae, and Sungho Jin, Journal of Nanomaterials 2013.