Article en deux volets traitant du dioxyde de titane, de ses procédés de synthèse (premier volet, ci-dessous) à ses applications en photocatalyse (second volet).
Introduction
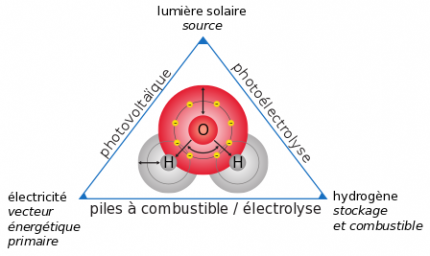
Au cours des dernières décennies, en raison d’une consommation énergétique croissante due aux modifications démographiques et de la limitation des ressources en combustible fossile, les sources d’énergies renouvelables telles que le soleil ont fait l’objet d’un certain nombre de projets de recherche (Figure 1). Dans le domaine solaire, les recherches portent notamment sur les cellules photovoltaïques et les cellules photo-électrochimiques, cellules qui décomposent l’eau en dihydrogène et dioxygène par photo-électrolyse, dont le tout premier exemplaire a été élaboré par Fujishima et Honda en 1972.
Ces cellules photo-électrochimiques mettent en jeu des matériaux ayant des propriétés photo-catalytiques (ils catalysent certaines réactions sous irradiation lumineuse). Parmi eux figure le semi-conducteur dioxyde de titane, TiO2, actuellement le photo-catalyseur de référence.
Le dioxyde de titane peut se présenter sous la forme d’une poudre blanche (Figure 2), est abondant et bon marché.
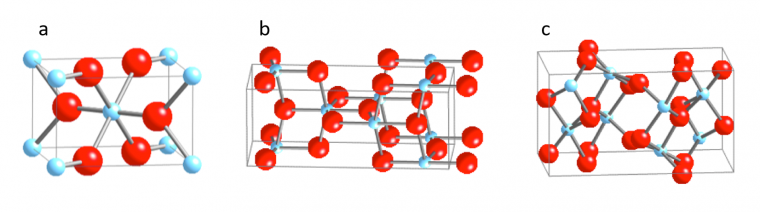
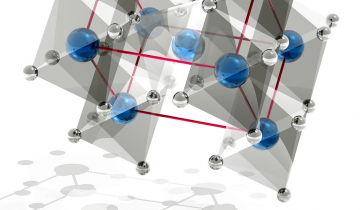
Il existe principalement sous trois structures cristallines : l’anatase, le brookite et le rutile (Figure 3).
Rutile en figure 3a, anatase en figure 3b et brookite en figure 3c ; les atomes d’oxygène sont représentés par des sphères rouges et ceux de titane par des sphères bleues.
Outre son application en photo-catalyse, relativement récente (quelques décennies), il est utilisé comme pigment blanc dans les peintures depuis près d’un siècle ; du fait de son indice de réfraction élevé (n = 2,7 pour la variété rutile), il possède un fort pouvoir opacifiant. Il est utilisable à la fois avec des liants aqueux et des liants huileux, d’où son usage massif (plusieurs millions de tonnes de dioxyde de titane sont préparées chaque année pour la formulation des peintures).
Par ailleurs, son absorption dans le domaine UV (il absorbe des rayonnements d’énergie supérieure à 3,2 eV soit de longueur d’onde inférieure à 380 nm) l’a conduit à être utilisé dans les crèmes solaires.
La suite de ce premier volet détaille des procédés de synthèse du dioxyde de titane. Le second volet présente quelques-unes de ses applications liées à ses propriétés photo-catalytiques, notamment comme revêtement auto-nettoyant.
Procédés de synthèse du dioxyde de titane
Il existe un certain nombre de procédés de synthèse du dioxyde de titane ; seuls quelques-uns sont présentés ci-après.
Synthèses en phase liquide
Voie sol-gel
Parmi les méthodes de synthèse en phase liquide, citons d’abord la voie sol-gel (contraction de « solidification-gélification »). Cette voie comporte deux étapes.
- Synthèse du « sol » :
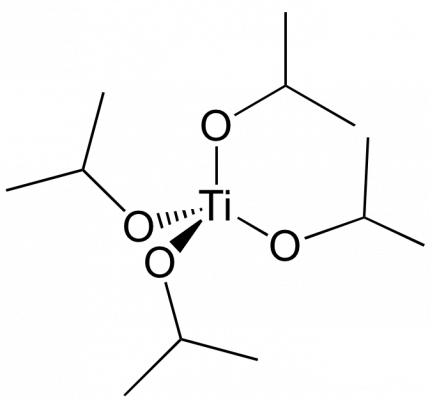
Un « sol » est défini comme étant une dispersion stable dans un liquide de particules colloïdales. La synthèse d’un « sol » se fait à température ambiante par ajout d’eau dans une solution organique acide ou basique contenant des précurseurs moléculaires. Elle met en jeu une réaction d'hydrolyse d'un précurseur de dioxyde de titane, souvent un alkoxyde de titane comme l’isopropoxyde de titane (Figure 4) ou un sel inorganique comme le tétrachlorure de titane TiCl4.
Équation de la réaction d’hydrolyse de l’alkoxyde métallique (par exemple Ti(OiPr)4) :
Ti(OR)4 + H2O → HO-Ti(OR)3 + ROH avec R = -iPr
Ces espèces hydroxylées sont réactives vis-à-vis de la condensation c’est-à-dire de la formation de ponts Ti-O-Ti. En effet, les groupements hydroxyle –OH sont nucléophiles et peuvent réagir avec des atomes métalliques qui sont électrophiles. La formation de petites espèces condensées va former un « sol » qui peut évoluer par le biais de réactions de condensation supplémentaires en un réseau tridimensionnel à viscosité infinie, appelé « gel ».
- Formation du « gel » :
Un gel est défini comme un système ayant un comportement de solide dans lequel les molécules de solvant (eau, alcool) sont emprisonnées dans un réseau réticulé. Lorsque le liquide est l’eau, on parle d’un aquagel ou hydrogel, si c’est de l’alcool, on parle d’alcogel.
Équation des réactions de condensation-polymérisation :
(OR)n-1Ti-OH + HO-Ti(OR)n-1 → (OR)n-1Ti-O-Ti(OR)n-1 + H2O
La poursuite de la condensation, ou polymérisation inorganique, et éventuellement la perte progressive du solvant convertit le « sol » en phase « gel » solide.
La synthèse de dioxyde de titane par voie sol-gel conduit le plus souvent à l’anatase avec une taille de particules nanométriques. La morphologie des particules peut être modifiée en modulant certains paramètres de la synthèse.
Cette voie sol-gel est notamment utilisée pour fabriquer du verre. Voici une vidéo illustrant ce procédé
Synthèses hydrothermale et solvothermale
La synthèse hydrothermale est un autre procédé chimique, surtout utilisé dans l’industrie des céramiques pour l’obtention de petites particules de TiO2. La réaction impliquant un précurseur de TiO2 se déroule en milieu aqueux, à des températures supérieures à 100 °C et à des pressions supérieures à 1 bar ; ce type de synthèse est couramment mené dans des autoclaves contrôlés en température et/ou en pression.
Des exemples de synthèse hydrothermale sont cités dans la littérature pour l’obtention de TiO2 sous forme de nanoparticules, nano-bandes ou nano-fils (Figure 5). Des nanotubes de TiO2 ont même été synthétisés par cette voie, dès 1998.
La méthode solvothermale est une variante de la synthèse hydrothermale. Dans cette méthode, la réaction entre l’eau et le précurseur à base de titane se déroule dans un milieu non-aqueux ; l’eau est introduite en faible quantité, en tant que réactif. Des températures plus élevées peuvent être obtenues si les solvants utilisés dans cette voie de synthèse ont des températures d’ébullition supérieures à celle de l’eau. Un meilleur contrôle de la taille, de la forme et de la cristallinité du TiO2 est obtenu par cette voie de synthèse.
Synthèses en phase gazeuse
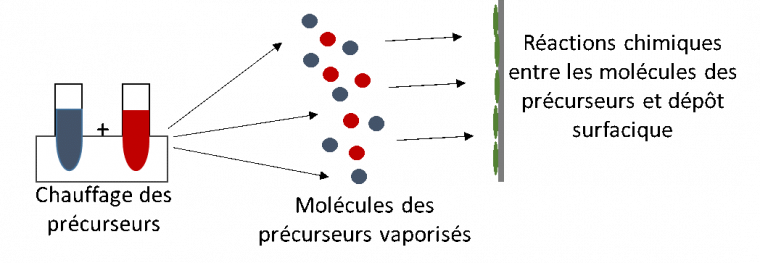
Les méthodes citées ci-dessus se déroulent toutes en phase liquide. Il existe des voies de synthèse de TiO2 qui se produisent en phase vapeur, telles que le dépôt chimique en phase vapeur (en anglais Chemical Vapor Deposition, abrégé en CVD), qui permet d’obtenir des films minces de dioxyde de titane.
Dans cette méthode, un film mince de TiO2 est généré sur un substrat, via une réaction entre précurseurs, qui a lieu à la fois en phase vapeur et au niveau de la surface du substrat. L’énergie nécessaire pour que la réaction entre les précurseurs aient lieu peut être apportée sous forme d’énergie thermique, sous forme d’énergie lumineuse (UV) ou par plasma (on parle alors de plasma-enhanced CVD ou PECVD), c’est-à-dire sous forme d’énergie électrique.
En pratique, les précurseurs sont chauffés (TiCl4 ou Ti(OiPr)4 et O2) dans une chambre de dépôt : les molécules de précurseurs sont alors vaporisées ; la réaction chimique entre les précurseurs a lieu en phase gazeuse et le dioxyde de titane se dépose sur un substrat (Figure 6).
Les films de TiO2 obtenus par cette méthode sont généralement épais mais cristallins, avec des tailles de grains inférieures à 30 nm.
Bibliographie (commune aux deux volets)
- Physique des semi-conducteurs, A.Chovet et P.Masson (2004-2005)-Ecole Polytechnique Universitaire de Marseille (Dept. de Micro-électronique et Télécommunications), 1-75.
- Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications and Applications, Xiaobo Chen and Samuel S. Mao (2007), Chem. Rev. (107) 2891-2959.
- Clefs du CEA n° 50/51, hiver 2004-2005.
- Thèse de Loraine Youssef, Développement par procédé plasma de couches minces de type TiO2 dopé à l'azote pour la production d 'hydrogène par photo-électrolyse de l 'eau sous lumière solaire, (2015-2018).
- http://hmf.enseeiht.fr/travaux/bei/beiere/content/2012-g01/les-procedes-doxydation-avancee#TiO2 /UV
- Les textiles photocatalytiques, Jean-Marie HERMANN, Actualité Chimique février-mars 2012.
- Le verre autonettoyant, Léthicia Guéneau-Rancurel, Actualité Chimique septembre 2007.
- Thèse de Laure PERUCHON, Caractérisations des propriétés photocatalytiques des verres autonettoyants – corrélation entre paramètres physico-chimiques et activité photocatalytique, 2007, https://tel.archives-ouvertes.fr/tel-00453175
- A surface science perspective on TiO2 photocatalysis, Michael A Henderson, Surface Science Reports, 2011.
- Données sur le dioxyde de titane de la Société Chimique de France
- Références des clichés obtenus par microscopie électronique à balayage (figure 5):
- nanotubes : Thèse Selima Benkara, Étude des propriétés électroniques et photoniques des couches minces à base d'oxydes nanostructurés, 2014.
- nanoparticules : Visible Light Irradiation-Mediated Drug Elution Activity of Nitrogen-Doped TiO2 Nanotubes, Seunghan Oh, Kyung-Suk Moon, Joo-Hee Moon, Ji-Myung Bae, and Sungho Jin, Journal of Nanomaterials 2013.