Ce quatrième volet du dossier intitulé Les interactions non-covalentes au service du traitement des canalopathies traite des applications des interactions non-covalentes dans le traitement de maladies appelées canalopathies, comme la mucoviscidose.
Le lecteur est invité à consulter au préalable les trois précédents volets du dossier
Répartition des ions de part et d'autre des membranes cellulaires
La concentration en ions de chaque côté d’une membrane cellulaire est différente. Si l'on place deux électrodes de part et d’autre de la membrane d'une cellule, il est possible d'observer une différence de potentiel, interprétée comme une différence de charge entre les deux côtés de la membrane. Ainsi, le milieu intracellulaire présente une charge négative par comparaison au milieu extracellulaire. On définit la différence de potentiel entre ces deux milieux comme le potentiel de repos membranaire. L’existence de ce potentiel est due au fait que la membrane cellulaire ne permet pas le passage d’espèces chargées.
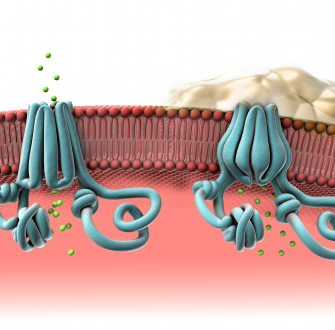
Pour que les ions puissent transiter à travers la membrane cellulaire, ils ont recours à des canaux ioniques (Figure 1). Ces protéines, incluses dans la membrane, assurent le passage des ions à travers cette dernière. Les principaux ions transitant à travers les membranes cellulaires sont le sodium (Na+), le potassium (K+), le calcium (Ca2+) et le chlorure (Cl-).
Le potentiel de repos membranaire est capital pour les cellules. Ainsi, lorsque des ions changent de compartiment, le potentiel de membrane est altéré et différents phénomènes peuvent se produire. Le potentiel de membrane est au cœur de nombreux processus biologiques comme la transmission nerveuse, la contraction musculaire, la digestion, l’hydratation cellulaire, et bien d’autres…
Par conséquent, un dysfonctionnement des canaux ioniques affecte les flux ioniques et les phénomènes qu’ils régulent, entrainant diverses pathologies. L’ensemble de ces pathologies est regroupé sous le nom de canalopathies. Elles sont, pour la plupart, d’origine génétique. Les canalopathies affectent de nombreux organes comme le cœur, le système nerveux, les muscles, les reins, les poumons, etc.
Un exemple de canalopathie : la mucoviscidose
La mucoviscidose est une maladie génétique grave. Elle fait partie des canalopathies et touche le foie, le pancréas et les poumons. Son origine est liée à différents défauts de la protéine CFTR, qui peuvent influencer sa fonctionnalité (absence ou anomalie d’expression), son positionnement membranaire (anomalie de repliement) ou encore sa stabilité (diminution de la disponibilité de la protéine).[1]
Ces protéines forment des canaux responsables du transport des ions chlorure à travers la membrane cellulaire. Pour mieux comprendre l’importance de ces canaux, intéressons-nous à leur implication dans le fonctionnement des poumons.
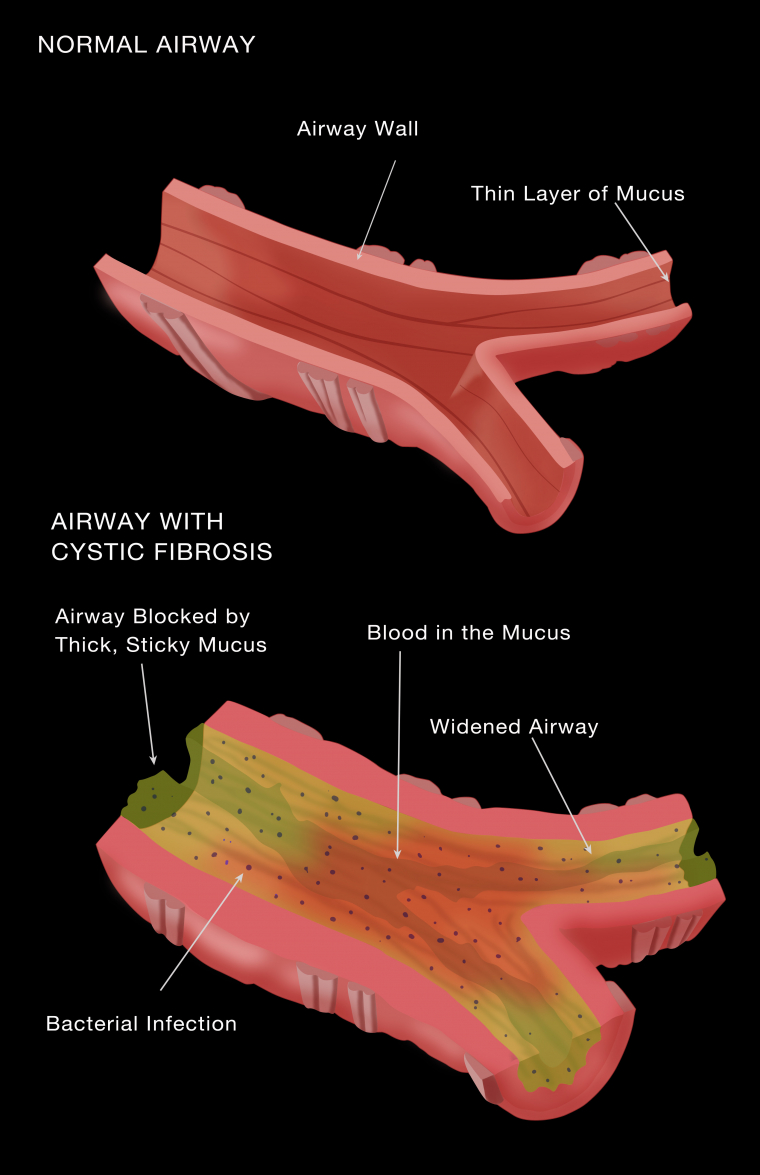
Dans des poumons sains, une fine couche de mucus fluide (constitué à 95% d’eau) recouvre les parois des voies respiratoires, notamment des bronches, et contribue à les protéger (Figure 2). Des bactéries et de petites impuretés s’y déposent. Grâce à la pression de l’air et aux mouvements des cils vibratiles présents dans les voies respiratoires, le mucus chargé d’impuretés remonte dans la gorge pour être expectoré ou avalé. [2]
En cas de mucoviscidose, le mucus est épais et difficile à évacuer. Chargé de bactéries, il s’accumule dans les poumons et provoque l’obstruction progressive des voies respiratoires. Les bactéries y trouvent un milieu favorable à leur multiplication, ce qui engendre des infections et des inflammations, avec le risque, à terme, de provoquer des lésions pulmonaires irréversibles. [2]
La fluidité du mucus est donc cruciale : elle est liée à sa teneur en eau, qui dépend elle-même d’échanges au niveau de canaux ioniques.
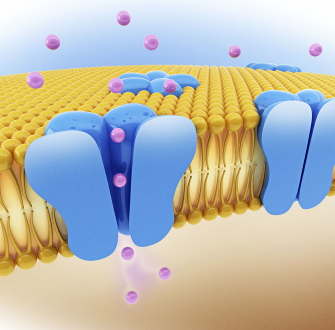
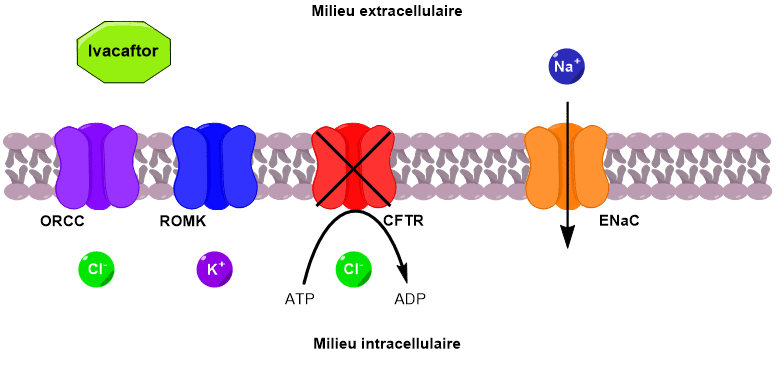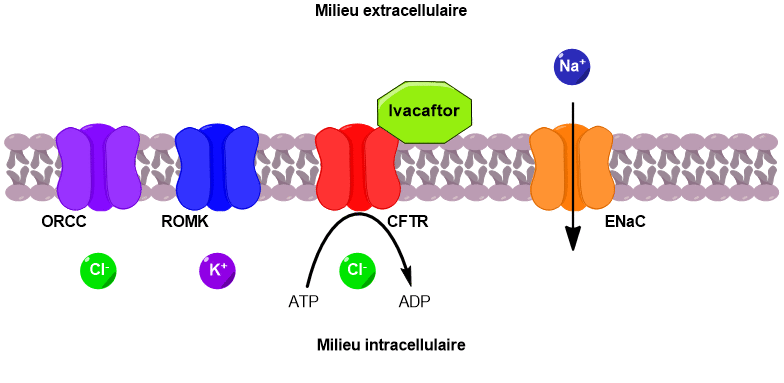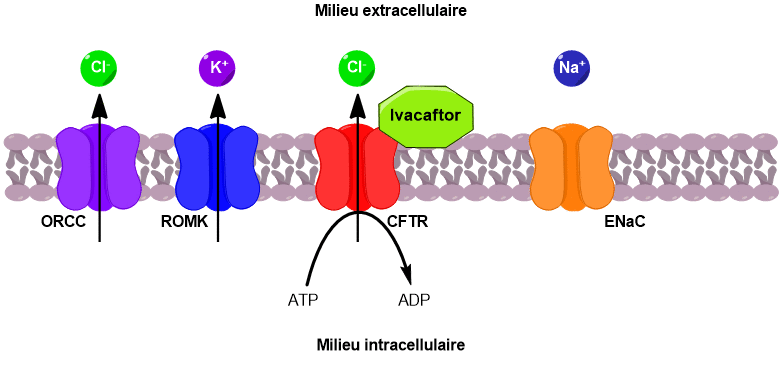
Ces échanges d’ions ont lieu au niveau des cellules de l’épithélium pulmonaire qui tapisse la paroi interne des bronches (Figure 3). Les parois de ces cellules présentent de nombreux canaux ioniques, notamment le canal CFTR.
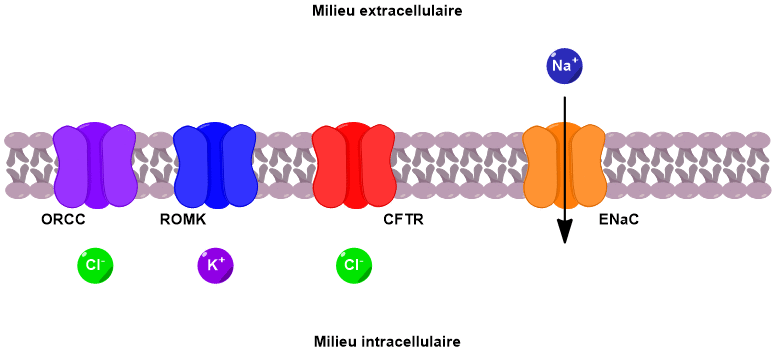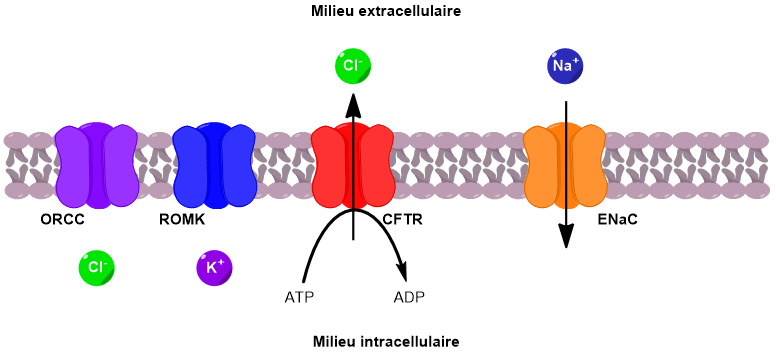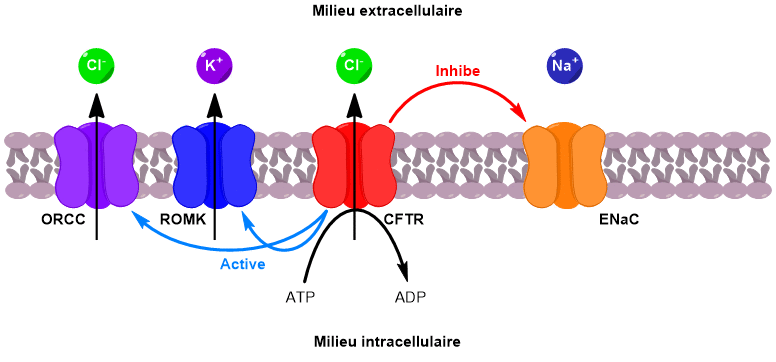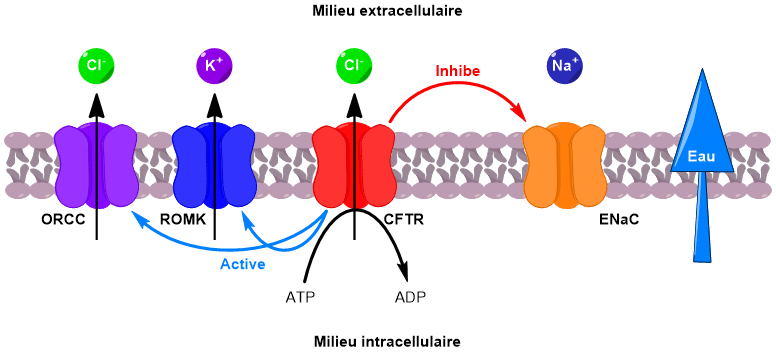
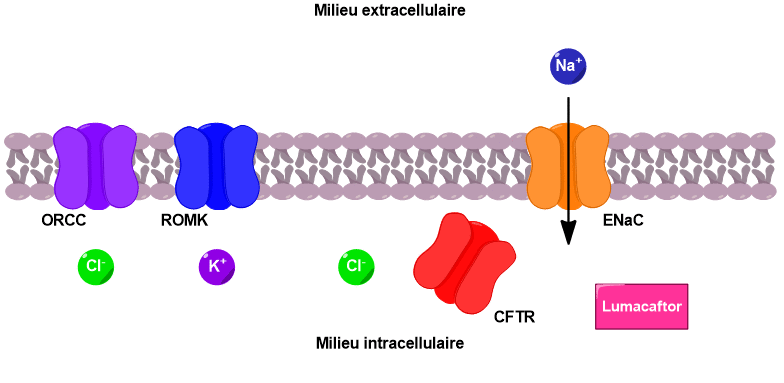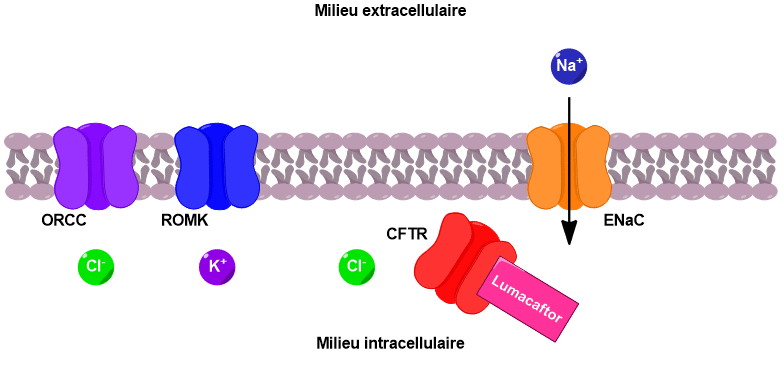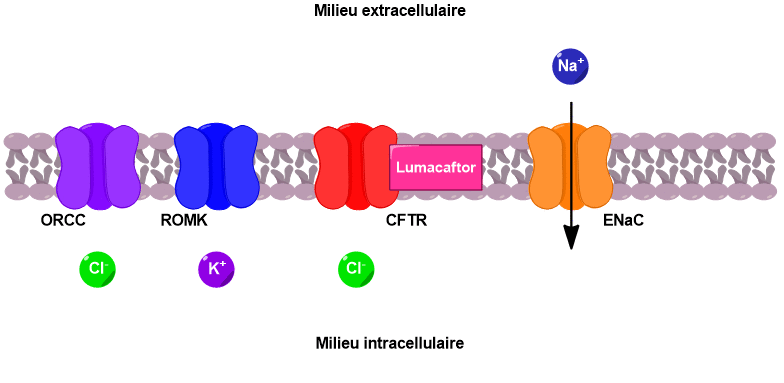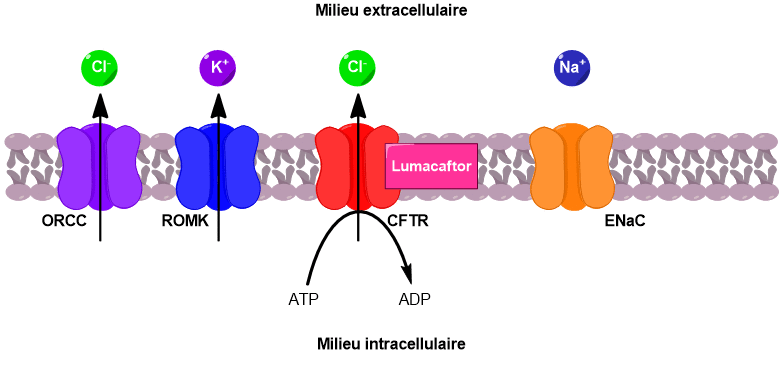
Le canal CFTR permet de faire passer des ions chlorure du milieu intracellulaire vers le milieu extracellulaire. Sous l’effet de ce flux d’ions chlorure, deux autres canaux sont activés, conduisant au passage d’ions potassium et chlorure supplémentaires vers l’extérieur de la cellule.
En parallèle, un canal faisant rentrer les ions sodium à l’intérieur de la cellule est désactivé. Il en résulte une augmentation de la concentration en ions dans le milieu extracellulaire. Un phénomène d’osmose se met alors en place pour équilibrer les concentrations. L’eau passe du milieu intracellulaire vers le milieu extracellulaire, venant ainsi fluidifier le mucus pulmonaire (Figure 4).
S’il existe plusieurs formes de mucoviscidose, toutes sont liées à un problème des canaux CFTR. Lorsque ces canaux sont absents de la membrane ou ne fonctionnent pas, alors la cascade de réactions décrite précédemment ne peut avoir lieu. Le mucus s’épaissit et adhère aux parois des bronches. Il n’est plus évacué, obstrue les poumons, gêne la respiration et favorise le développement d’infections. Un mécanisme similaire a lieu au niveau des voies biliaires et du pancréas. L’accumulation de bile et de sucs digestifs conduit respectivement à des lésions du foie et du pancréas.
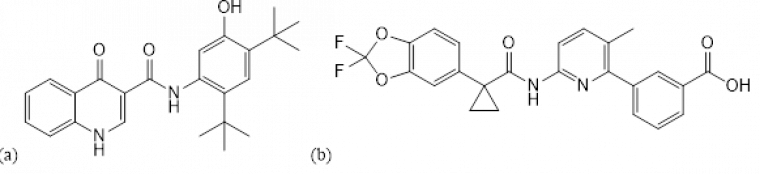
Deux médicaments ciblant les canaux CFTR sont utilisés dans le traitement de la mucoviscidose : l’ivacaftor et le lumacaftor (Figure 5).
L’ivacaftor permet d’améliorer le transport des ions en ciblant les canaux CFTR dysfonctionnels présents sur la membrane. Il permet d’augmenter la probabilité d’ouverture du canal (Figure 6). Ce médicament est donc efficace uniquement en cas de canaux CFTR déjà présents dans la membrane, mais défaillants.
Le lumacaftor quant à lui permet de guider les canaux CFTR présents, même en nombre restreints, à l’intérieur de la cellule afin de favoriser leur intégration à la membrane (Figure 7). Ces deux molécules ne peuvent être utilisées que chez certains patients atteints de formes précises de la mucoviscidose qui possèdent des canaux CFTR, même partiellement. Mais pour les patients qui en sont totalement dépourvus, ces molécules sont inutiles et d’autres d’approches thérapeutiques doivent être développées.
Thérapie de restauration des canaux ioniques par les transporteurs d'anion : vers un traitement alternatif pour les canalopathies
Les thérapies de restauration des canaux ioniques visent à remplacer les canaux absents ou défaillants du patient. La thérapie génique s’inscrit dans cet objectif en introduisant un gène chez le patient, afin que ses cellules soient en mesure de produire les protéines manquantes. Une alternative a été développée ces dernières années sous la forme des transporteurs d’ions.
Les transporteurs d’ions sont des petites molécules pouvant remplir la fonction des canaux ioniques. Telle une prothèse qui viendrait remplacer un os brisé, les transporteurs d’ions viennent remplacer les canaux ioniques. Ils vont se lier aux ions, leur faire traverser la membrane puis les relâcher. La liaison aux ions doit être relativement faible pour permettre au transporteur de relâcher l’ion une fois la membrane traversée. Les liaisons non covalentes décrites précédemment présentent donc les caractéristiques idéales pour ces transporteurs.
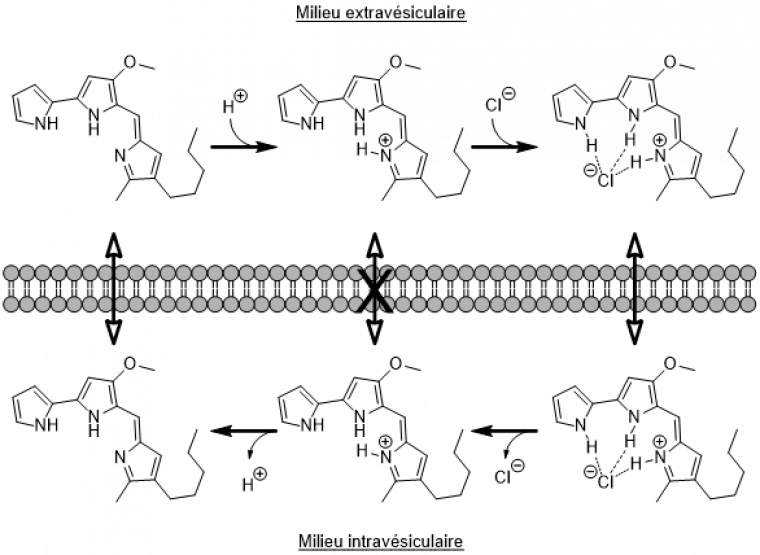
L’une des sources d’inspiration majeures de cette approche est une molécule naturelle, la prodigiosine. Cette molécule est produite par les bactéries de l’espèce Serratia marcescens. Elle peut assurer le passage d’ions à travers les membranes lipidiques des organelles des cellules, notamment des lysosomes.[3,4] La prodigiosine fixe un ion H+ puis, par la combinaison d’une liaison ionique et de deux liaisons hydrogène, capte un ion chlorure avant de lui faire traverser la membrane et de le relâcher dans le milieu intravésiculaire ou extravésiculaire (Figure 8). Ce transport a été observé en temps réel par Cheung et son équipe en 2018.[5]
La recherche de nouveaux transporteurs d’ions plus efficaces a conduit au développement de nombreuses propositions par les scientifiques et aujourd’hui une grande variété de molécules a été testée afin de remplacer les canaux ioniques.
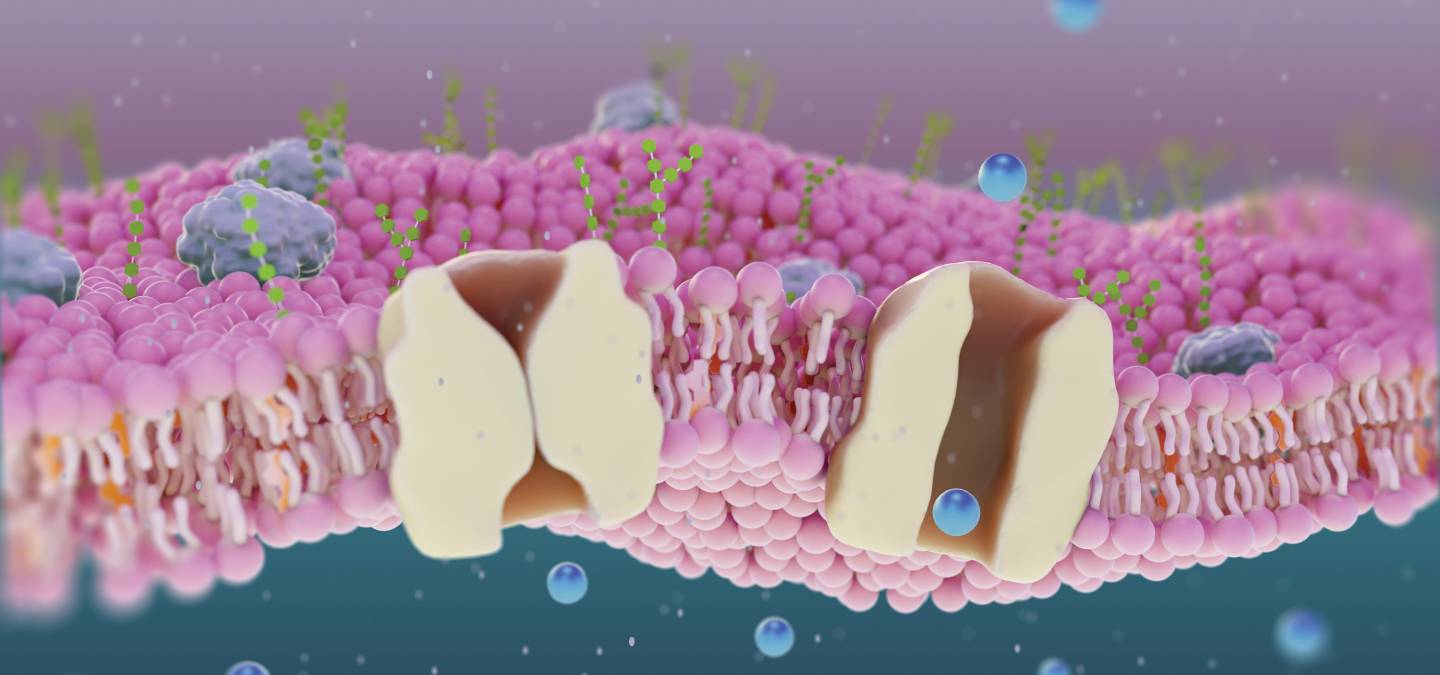
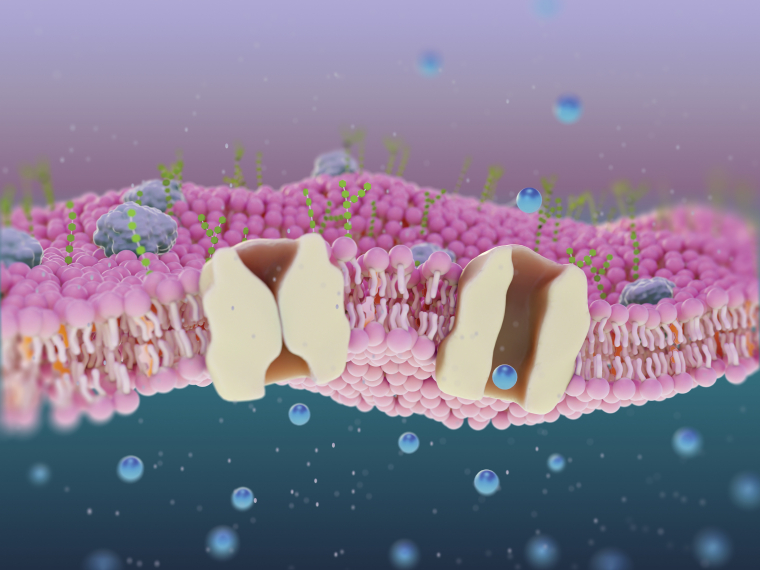
Plusieurs types de transporteurs ont pu être proposés. [6,7] Tout d’abord, les transporteurs mobiles (Figure 9). Ils s’inspirent de la prodigiosine. Ce sont de petites molécules incapables de s’intégrer à la membrane, mais pouvant la traverser une fois liées à un ion. Ces molécules sont très sélectives et limitées par leur vitesse de diffusion à travers la membrane, en ne transportant qu’un ion à la fois.
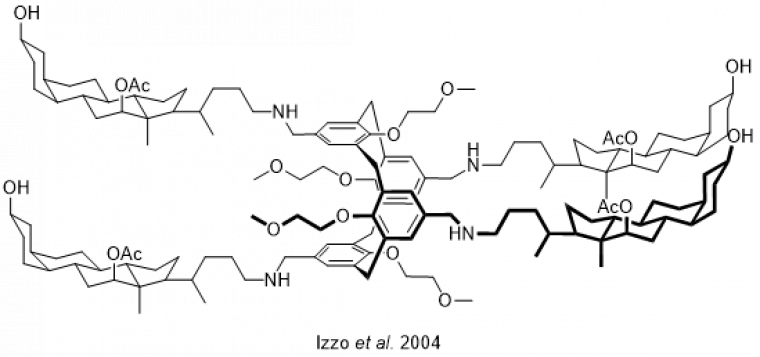
Une seconde catégorie est celle des canaux monomériques (Figure 10). Il s’agit de molécules plus grandes, qui vont former un tunnel au sein de la membrane, permettant de faire passer les ions. Le transport induit est plus rapide qu’avec les transporteurs mobiles. Cependant, leur grande taille en fait des molécules qu’il peut être plus difficiles à faire transiter jusqu’à la bonne cellule dans l’organisme.
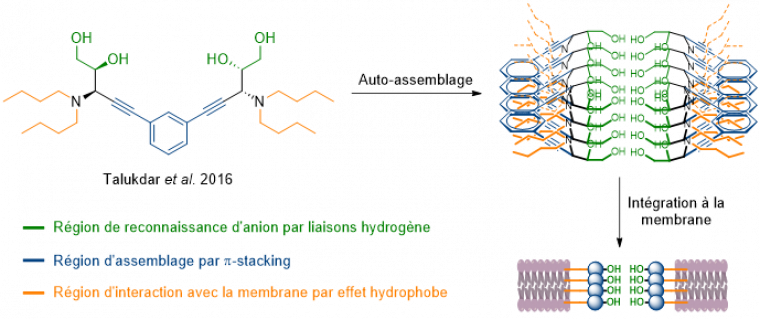
Pour répondre aux problématiques de vitesse et de devenir dans l’organisme, une troisième catégorie a été développée. Il s’agit des pores « auto-assemblés » (Figure 11). Ces derniers forment, par le regroupement de petites molécules, un pore permettant le passage des ions. Cet auto-assemblage repose sur des interactions non covalentes, le plus souvent de type π-stacking. Malheureusement, la nature dynamique de ces structures induit des difficultés pour obtenir une bonne sélectivité des anions à transporter.
Dans les auto-assemblages, les interactions non covalentes sont au cœur de ces structures. Elles interviennent à trois niveaux : reconnaissance des ions, assemblage et intégration aux membranes. Tout d’abord, comme nous l’avons vu pour la prodigiosine, ce sont elles qui permettent la reconnaissance, le transport et le relargage des ions. La plupart des formes d’interactions non covalentes ont pu être testées dans de nombreuses combinaisons. En plus de l’utilisation des liaisons hydrogène et ionique combinées dans la prodigiosine, on peut citer de manière non exhaustive les combinaisons : hydrogène/π-anion ; halogène/π-anion ou encore pnictogène/π-anion. Les interactions non covalentes sont également au cœur de l’assemblage d’une catégorie de transporteurs très prometteuse. Enfin, les effets hydrophobes jouent un rôle majeur. En effet, l’intérieur de la membrane étant hautement hydrophobe, il est nécessaire, pour que le transporteur agisse, qu’il puisse s’appuyer sur ces effets pour bien s’intégrer à la membrane.
Conclusion
Les canaux ioniques permettent le transport des ions au niveau des membranes cellulaires, transport qui est impliqué dans de nombreux phénomènes physiologiques majeurs et fait l’objet d’une régulation très fine par l’organisme. Les dysfonctionnements des canaux ioniques sont à l’origine d’un ensemble de pathologies appelées canalopathies. Pouvant toucher de nombreux organes, les conséquences de ces pathologies peuvent être gravissimes voir létales, comme dans le cas de la mucoviscidose.
Devant les dysfonctionnements des canaux ioniques, diverses approches thérapeutiques ont été proposées. L’une d’entre elles vise à restaurer le transport d’ions par l’utilisation de transporteurs d’ions. Ces molécules, dont on trouve l’inspiration parmi les substances naturelles, s’appuient sur l’utilisation de différentes interactions non covalentes pour faire passer des ions à travers les membranes cellulaires.
La grande variété des interactions non covalentes représente une formidable boîte à outils chimique permettant de moduler les propriétés des transporteurs. C’est en exploitant la richesse de ces interactions qu’il est aujourd’hui possible de faire les premiers pas vers le développement de nouveaux traitements innovants de ces maladies graves.
Bibliographie
[1] C. Férec, « Mucoviscidose : Des pistes thérapeutiques encourageantes », 2021.
[2] « C’est quoi la mucoviscidose ? – Impact sur l’organisme – Poumons, Foie et intestins », 2023.
[3] T. Sato, H. Konno, Y. Tanaka, T. Kataoka, K. Nagai, H. H. Wasserman, S. Ohkuma, J. Biol. Chem. 1998, 273, 21455–21462.
[4] T. Kataoka, M. Muroi, S. Ohkuma, T. Waritani, J. Magae, A. Takatsuki, S. Kondo, M. Yamasaki, K. Nagai, FEBS Lett. 1995, 359, 53–59.
[5] S. Cheung, D. Wu, H. C. Daly, N. Busschaert, M. Morgunova, J. C. Simpson, D. Scholz, P. A. Gale, D. F. O’Shea, Chem 2018, 4, 879–895.
[6] B. A. McNally, W. M. Leevy, B. D. Smith, Supramol. Chem. 2007, 19, 29–37.
[7] P. A. Gale, J. T. Davis, R. Quesada, Chem. Soc. Rev. 2017, 46, 2497–2519