Le bleu de méthylène est initialement réduit par le glucose. La cinétique est observable à notre échelle (quelques secondes), et la couleur disparaît progressivement. Puis, lorsqu'on agite la fiole...
Introduction
Nous allons visuellement mettre en évidence la renversabilité d'une réaction rédox.
-
Le bleu de méthylène est une molécule organique, qui peut exister sous les deux formes :
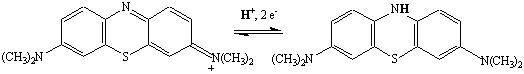
forme Oxydée : bleue forme Réduite : incolore
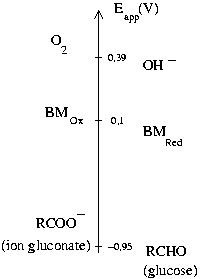
de potentiel rédox standard : E° (pH = 0) = 0,52 V, soit Eapp(pH = 14) = 0,10 V.
-
Le glucose quant à lui est un réducteur (fonction aldéhyde) qui intervient dans la demi-équation rédox suivante :
HOCH2(CHOH)4CHO + 3 OH- → HOCH2(CHOH)4CO2- + 2 H2O + 2 e-, de potentiel apparent Eapp(pH = 14) = - 0,95 V
-
Enfin, le dioxygène intervient comme oxydant puissant dans le couple :
1/2 O2 + H2O + 2 e- → 2 OH- Eapp(pH = 14) = 0,39 V
On peut visualiser l'aspect catalytique du bleu de méthylène sur le graphe suivant :
Expérience
Protocole expérimental
Des pastilles de potasse ont été dissoutes dans la fiole, ainsi que du glucose et du bleu de méthylène.
Le mélange obtenu est agité vigoureusement dès que la couleur bleue disparaît.
Réalisation de l'expérience
Voir ci-dessous la séquence expérimentale provenant du site Chemical Education administré par l'équipe du Dr. George Bodner.
Observations et interprétations
Le bleu de méthylène est initialement réduit par le glucose. La cinétique est observable à notre échelle (quelques secondes), et la couleur disparaît progressivement. Puis, lorsqu'on agite la fiole, du dioxygène gazeux présent dans l'air contenu dans la fiole s'y dissout (on augmente en agitant la cinétique de dissolution du dioxygène dans la solution : O2 (g) = O2 (d)). Le dioxygène alors dissous réoxyde la forme réduite du bleu de méthylène, et la couleur bleue réapparaît ! Tant qu'il reste du glucose en solution et du dioxygène dans la fiole bouchée, le cycle peut reprendre...
Finalement, le bleu de méthylène sert de catalyseur à la réaction globale :
HOCH2(CHOH)4CHO + 1/2 O2 (g) + OH- → HOCH2(CHOH)4CO2- + H2O.
En effet, son potentiel apparent à pH = 14 (0,1 V) est compris entre ceux des deux autres couples (O2/OH- : 0,39 V et ion gluconate/glucose : - 0,95 V)
Bibliographie pour approfondir
-
M. Bernard et F. Busnot Usuel de chimie générale et minérale Ed. Dunod,
-
J. Sarrazin et M. Verdaguer L'oxydoréduction, concepts et expériences. Ed. Ellipses, 1991
-
M. Blanchard, B. Fosset, F. Guyot, L. Jullien, S. Palacin Chimie organique expérimentale Ed. Hermann, 1987







