Cette fiche explique le principe de l'évaporation d'un solvant à l'évaporateur rotatif et la mise en oeuvre expérimentale de celle-ci.
Contexte
En fin de synthèse, deux situations peuvent se présenter :
- Soit le produit attendu n’est pas soluble dans le milieu réactionnel et est le seul à précipiter : on l’isole par essorage, généralement sous pression réduite, pour obtenir un produit sous forme solide.
- Soit le produit attendu est soluble dans le milieu réactionnel. On procède à plusieurs extractions visant à concentrer le produit dans la phase organique et à des lavages avec des solutions aqueuses visant à éliminer les sous-produits ou les impuretés. À l’issue de cette séquence, on obtient une phase organique contenant un solvant, le produit attendu et éventuellement des impuretés. Une fois cette phase organique séchée (pour éliminer toute trace d’eau), on cherche à séparer le produit attendu du solvant. On utilise pour cela un évaporateur rotatif.
Principe de l’évaporation d’un solvant à l’évaporateur rotatif
Comme la phase organique séchée est un mélange homogène liquide, on réalise une distillation, dont le but est de séparer le solvant des autres constituants du mélange (le produit synthétisé et d’éventuels sous-produits ou impuretés).
Distillation simple
Comme le solvant est généralement très volatil par rapport autres constituants du mélange (le produit obtenu en fin de synthèse + les éventuels sous-produits et impuretés), une distillation fractionnée n’est pas nécessaire et une distillation simple suffit. Un évaporateur rotatif permet de réaliser une distillation simple sous pression réduite.
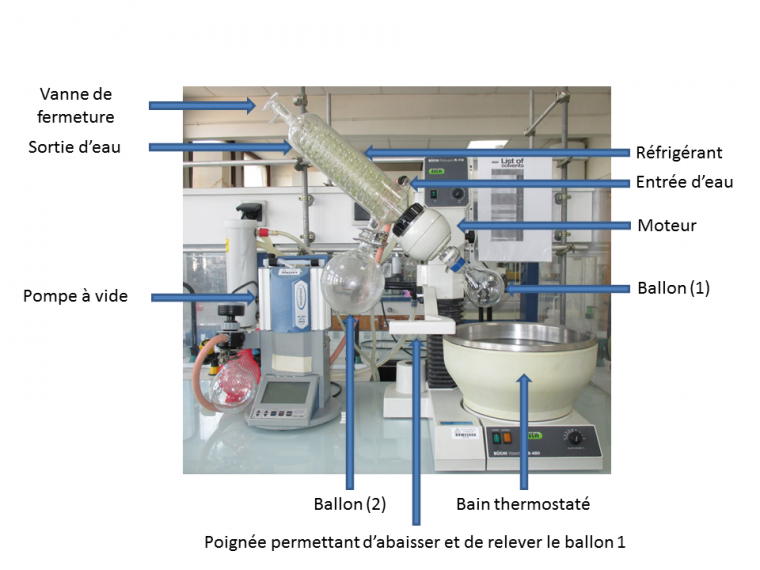
Il est constitué notamment (Figure 1) :
- d’un ballon (1) dans lequel on place le mélange contenant le solvant à évaporer ;
- d’un bain-marie avec contrôle de température ;
- d’un réfrigérant en forme de serpentin, permettant aux vapeurs de solvant de se liquéfier ;
- d’un ballon (2) permettant de récupérer le solvant liquide (après liquéfaction des vapeurs) ;
- d’un moteur permettant de mettre en rotation le ballon contenant le mélange à évaporer, afin d’obtenir une évaporation plus régulière.
Il est relié à un système permettant d’abaisser la pression au sein du dispositif (une pompe par exemple).
Le ballon (1) contient le mélange dont on veut évaporer le solvant. Le solvant s’évapore et les vapeurs ainsi formées sont condensées par le réfrigérant dans un récipient différent du ballon (1) : le ballon de récupération (2).
Intérêt de travailler sous pression réduite
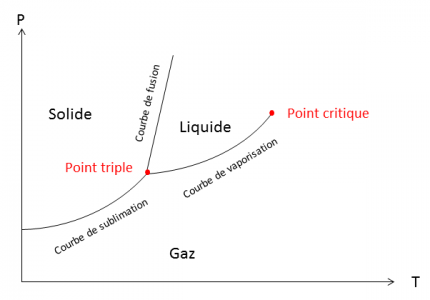
On remarque sur le diagramme que la température d’ébullition diminue si la pression diminue (Figure 2).
Il existe des abaques pour connaître la température d’ébullition d’un produit connaissant sa température à pression atmosphérique et la pression dans l’enceinte.
Le fait de placer le montage d’évaporation sous pression réduite permet d’abaisser la température d’ébullition des constituants du mélange (et donc en particulier celle du solvant à évaporer). Le chauffage nécessaire pour évaporer le solvant en est alors diminué. On utilise un bain thermostaté car l’évaporation est endothermique ; sans cela, la température baisserait rapidement au sein du ballon (il se recouvrerait de givre). Le ballon est mis en rotation pour maintenir une température uniforme au sein du mélange à évaporer.
Au final, l’évaporateur rotatif permet d’évaporer rapidement un solvant à une température relativement basse.
On sait que l’évaporation est terminée :
- si le volume de solvant récupéré dans le ballon (2) n’augmente plus ;
- si la masse du contenu du ballon (1) est constante.
Après évaporation du solvant, on récupère :
- soit un solide si le produit synthétisé est solide à température et pression ambiantes ;
- soit une huile si le produit synthétisé est liquide à température et pression ambiantes.
Mise en oeuvre
Dans cette vidéo, le solvant évaporé est l’éther diéthylique, qui est très volatil (température d’ébullition de 35 °C à pression atmosphérique). Il n’a donc pas été utile d’abaisser la pression dans le montage dès le début de l’évaporation.
Lors de l’évaporation d’autres solvants, on abaisse la pression dans le montage dès le début de l’évaporation (ce qui permet de moins chauffer). Les opérations à mettre en œuvre, sont :
- mettre en route le chauffage du bain-marie et attendre que la température désirée soit atteinte ;
- mettre en route la circulation d’eau dans le réfrigérant ;
- fixer le ballon contenant le mélange ;
- mettre en route la rotation du ballon ;
- allumer le dispositif permettant d’abaisser la pression (trompe à eau ou pompe à vide) ;
- fermer la vanne pour mettre le montage sous pression réduite ;
- abaisser le ballon contenant le mélange à évaporer dans le bain-marie (le niveau de l’eau du bain-marie doit être à peu près celui du niveau du liquide).
Lorsque l’évaporation est terminée, on réalise les opérations ci-dessus en sens inverse :
- remonter le ballon contenant le mélange à évaporer pour le sortir du le bain-marie ;
- ouvrir la vanne pour mettre le montage sous pression atmosphérique ;
- éteindre le dispositif permettant d’abaisser la pression (trompe à eau ou pompe à vide) ;
- arrêter la rotation du ballon ;
- détacher le ballon ;
- arrêter la circulation d’eau dans le réfrigérant ;
- arrêter le chauffage du bain-marie.
Il y a quelques précautions à prendre lors de l’utilisation d’un évaporateur rotatif :
- selon le solvant à évaporer, l'ébullition peut produire une forte ébullition qui a pour effet de remonter le liquide jusqu’à l’entrée du réfrigérant. Pour éviter cela, on peut :
- augmenter la vitesse de rotation du ballon ;
- garder une main sur la vanne de fermeture et contrôler manuellement la pression à l’intérieur du montage.
- L’évaporateur étant constitué d’éléments en verre et mis en dépression, le risque d’implosion existe, particulièrement en cas de défaut ou de faiblesse d’un élément comme une fêlure sur la verrerie. Certaines pièces de verrerie sont recouvertes d’un revêtement en plastique et/ou par des filets, pour éviter des blessures dues aux morceaux de verre.