Dans cet article, Bastien Nay nous amène à réfléchir aux enjeux de la synthèse totale. La rétrosynthèse y est présentée, ainsi que la notion de synthèse idéale. Les apports de l'intelligence artificielle sont également discutés.
Introduction : pourquoi synthétiser ?
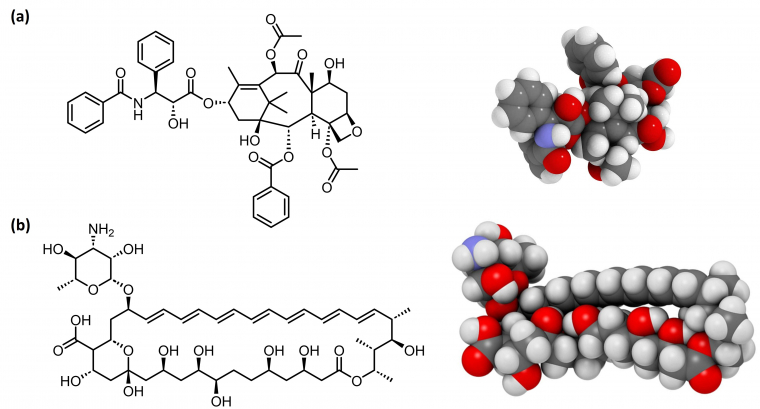
La synthèse totale est un domaine de la chimie organique qui a pour but la préparation de molécules d'intérêt, généralement complexes et douées de propriétés biologiques (Figure 1), à partir de substances simples et abondantes. Plus généralement, la synthèse organique est essentielle à la société puisqu'elle permet la préparation de substances aussi diverses que des médicaments, parfums, colorants, pesticides, détergents, colles, polymères, et bien d'autres. Elle est donc centrale dans notre vie quotidienne.
En tant que domaine populaire parmi les chimistes organiciens, la synthèse totale se focalise le plus souvent sur la préparation de molécules d'origine naturelle (Figure 1), dans le but de :
- développer de nouveaux médicaments ou molécules actives ;
- étudier les propriétés de la molécule cible (activités biologiques, réactivité...);
- vérifier une structure chimique restée incertaine après analyses spectroscopiques ;
- tester et valider l'intérêt de nouvelles réactions chimiques ;
- démontrer le potentiel d'une stratégie de synthèse courte et originale ;
- former la prochaine génération de chimistes.
Ce dernier point est particulièrement important car la synthèse totale nécessite d'appliquer un volumineux arsenal de réactions chimiques, participant ainsi au développement de l'expertise des futurs chercheurs (connaissances en chimie organique et gestion de projet complexe) (Figure 2). De plus, la synthèse totale n'est pas seulement utilisatrice de nouvelles méthodes, mais aussi pourvoyeuse de nouvelles observations sur la réactivité des intermédiaires de synthèse, conduisant parfois à la découverte de nouvelles réactions ou de nouvelles règles (on parle alors de sérendipité pour ces découvertes fortuites). Citons par exemple les règles de Woodward-Hoffmann sur la conservation de la symétrie orbitalaire, découvertes à l'occasion de synthèses totales réalisées dans les années 1960 (vitamine B12, vitamine D).1,2
Bientôt 200 ans d'histoire de la synthèse totale
La synthèse de l'urée par Wöhler en 1828, réalisée en chauffant du cyanate d'ammonium, est considérée comme la toute première synthèse d'une substance naturelle [3]. Un nombre croissant de composés ont ensuite été produits par synthèse au cours du XIXe siècle, comme les colorants (indigo, alizarine), les parfums (coumarine, camphre, terpinéol) ou l'aspirine. Des structures de plus en plus complexes ont alors été ciblées (quinine, morphine, strychnine, stéroïdes...). Cette évolution a participé à l'essor de l'industrie chimique et à la découverte de médicaments (antibiotiques, anticancéreux, par exemple), accompagnant l'accroissement rapide de l'espérance de vie durant le XXe siècle. À partir de 1950, les synthèses complexes ont été rendues possibles par la combinaison de la logique rétrosynthétique (voir ci-dessous) et de forts développements méthodologiques [4]. À partir des années 2000, le caractère préparatoire de la synthèse totale est largement exploité [5], alors que des structures très complexes sont synthétisées à grande échelle à des fins médicinales [6], par exemple : le mésylate d'éribuline (anticancéreux) [8], l’artémisinine (antipaludique) [9], ou le discodermolide (anticancéreux) [7]. Aujourd'hui, le mésylate d'éribuline est un des médicaments les plus complexes produit par synthèse totale en plus de 60 étapes non linéaires (voir la discussion plus loin), à l'échelle de l'hectogramme dans l'industrie (Figure 3). Le cas de l'artémisinine est particulier car elle a été produite par hémisynthèse, qui diffère de la synthèse totale par l'utilisation d'un produit de départ déjà très élaboré (elle est aujourd’hui principalement produite par extraction à partir de l'armoise annuelle). Quand au discodermolide, il a été synthétisé à l’échelle de 60 g pour des études cliniques de ses propriétés anticancéreuses, mais n’a finalement pas été commercialisé.
Les substances naturelles, cibles privilégiées de la synthèse totale
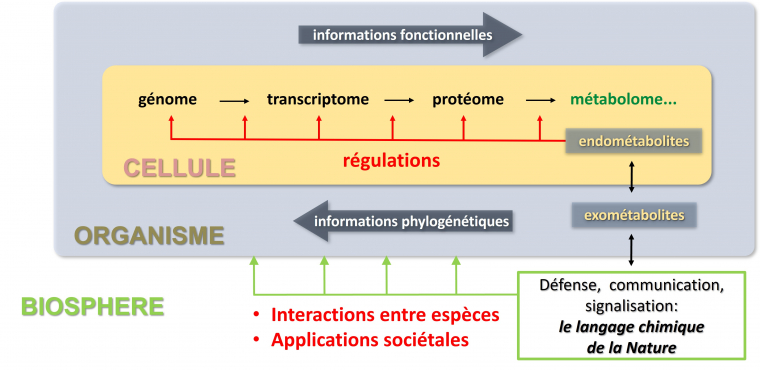
La synthèse totale est donc un terme généralement associé à la synthèse de substances naturelles ou de molécules apparentées, parfois de médicaments complexes. Cette complexité constitue toujours un défi très attrayant et une immense source d’inspiration pour les chimistes de synthèse. Les substances naturelles ciblées par la synthèse totale sont par définition des petites molécules (de masse molaire généralement inférieure à 1000) produites par des organismes vivants (plantes, animaux, micro-organismes) à des fins de régulation (hormones), de communication (phéromones), de défense (toxines, antiappétants, phytoalexines) (Figure 4) [10]. On les nomme aussi métabolites spécialisés, anciennement métabolites secondaires. Constituant un des langages de la nature, elles sont donc souvent biologiquement actives, ce qui les rend particulièrement attractives pour la recherche de nouveaux médicaments. Actuellement, un tiers des petites molécules-médicaments disponibles dans le commerce sont des substances naturelles ou des dérivés [11, 12]. Cependant, les substances naturelles sont souvent isolées en petites quantités (échelle du milligramme), ce qui limite l'étude de leurs propriétés. La synthèse totale est donc utile si l’on veut produire de plus grandes quantités de composés, a fortiori vers la commercialisation d'un médicament.
Dans les organismes vivants, les substances naturelles font partie du pool de métabolites (le métabolome) et sont fabriquées par des enzymes (une part du protéome encodé dans le génome) lors de la biosynthèse (Figure 4).
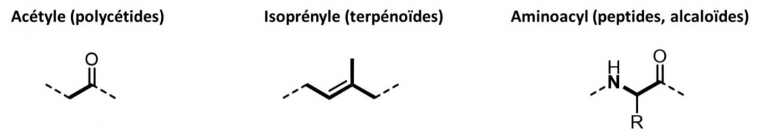
Toutes les voies de biosynthèse utilisent un nombre limité de blocs de construction métaboliques (acétylcoenzyme A donneur du bloc acétyle pour les polycétides, diphosphate de diméthylallyle donneur du bloc isoprényle pour les terpènes ou acides aminés donneur du bloc alkylamine pour les alcaloïdes, voire Figure 5), et un nombre limité de réactions chimiques relativement simples et bien connues des chimistes organiciens [13]. Pourtant, la diversité chimique des substances naturelles est immense et leur complexité peut être fascinante. Il devient alors logique d'envisager de mimer une voie de biosynthèse, qui a lieu naturellement in vivo, pour réaliser la synthèse totale d'une substance naturelle au laboratoire. On parle dans ce cas de synthèse biomimétique, bien que le processus biomimétique soit généralement limité à une étape-clé [14]. On peut aussi noter qu'une partie de la « biologie de synthèse », à travers les biotechnologies, cherche à reproduire certaines de ces voies métaboliques in vivo, et qu'elle peut être très complémentaire de la chimie de synthèse dans l'objectif de produire des molécules d'intérêt [15].
Echafauder la complexité moléculaire : l'apport de la rétrosynthèse
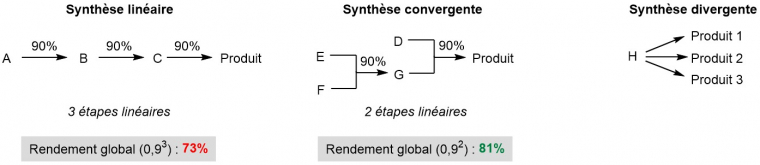
Dès les années 1950, l'idée d'utiliser des stratégies de synthèse dites convergentes, plus économes et plus pratiques que les stratégies linéaires (Figure 6), est envisagée. Il s'agissait de pouvoir réaliser la synthèse à grande échelle de molécules complexes à fort intérêt médicinal, par exemple des stéroïdes [16]. La logique de la synthèse organique est alors conceptualisée par Corey, qui introduit le terme « rétrosynthèse » pour parler de la conception d'une stratégie de synthèse, et dont les travaux seront récompensés par un prix Nobel de Chimie en 1989 [17].
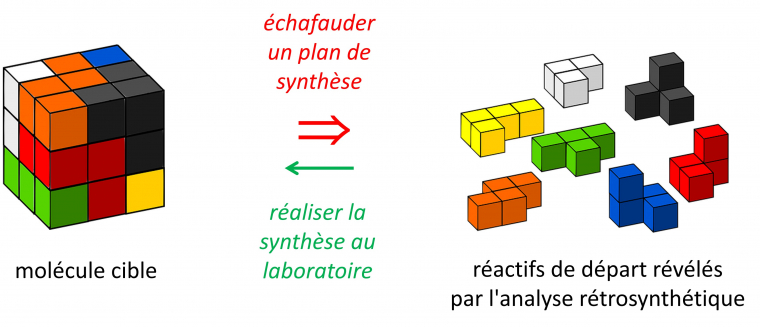
La rétrosynthèse d'une structure-cible complexe consiste à la déconnecter (au sens de « démonter ») en fragments de plus en plus simples (les « synthons »), selon des règles logiques de réactivité, au cours d'un processus intellectuel visant à mettre en place une stratégie de synthèse applicable en laboratoire (Figure 7). Il s'agit donc de concevoir le plan de construction d'une architecture moléculaire, tout en identifiant les étapes-clés de la synthèse (généralement celles qui vont amener l'essentiel de la complexité moléculaire). Il est à noter que la complexité moléculaire dépend de la présence d'éléments structuraux tels que la taille moléculaire, la topologie des liaisons chimiques et la connectivité cyclique, le contenu en groupements fonctionnels, la présence plus ou moins dense de centres stéréogènes, ou encore la présence de centres de haute réactivité chimique, source d'instabilité.
Deux principes doivent être ciblés :
- utiliser une stratégie convergente (par opposition à une stratégie linéaire, Figure 6) pour améliorer la praticité de la synthèse et diminuer les risques (voir notamment la discussion de Glwadys Gagnot) ;
- et déconnecter la molécule-cible à proximité de fonctions chimiques, ce qui permet de mettre en évidence la réactivité des nouveaux fragments produits (les synthons).18 En pratique, au cours de la synthèse totale, cette fonction chimique sera le résultat de la réaction des deux synthons entre eux.
Dans tous les cas, l'objectif principal de l'analyse rétrosynthétique est la réduction de la complexité pour aboutir après plusieurs étapes rétrosynthétiques à des fragments simples.
Enfin, ces stratégies de synthèse permettent de cibler soit la complexité d’un produit unique, soit la diversité chimique de plusieurs produits (Figure 6). Les synthèses orientées vers la diversité (et d'autres approches comme les synthèses combinatoires) sont très utiles en chimie médicinale pour générer des "bibliothèques" de composés en vue de tests biologiques. Les synthèses totales collectives (ou divergentes) permettent de synthétiser plusieurs substances naturelles complexes de la même famille, à partir d'un intermédiaire commun, sans changer de stratégie de synthèse.
Une affaire personnelle
La psychobiologie de l'approche rétrosynthétique
Il est intéressant de souligner que le processus de rétrosynthèse est une opération complexe faisant appel tant à la logique qu'à la créativité du chimiste. Cela a été décrit comme la psychobiologie de l'analyse rétrosynthétique, distinguant les actions analogiques (analyse, compréhension, logique) et les actions instinctives (créativité, intuition, art) [19]. Ces deux influences conduiront à des approches de synthèse très différentes selon les sensibilités et la culture scientifique du chimiste ou selon les objectifs visés. Elles pourront conditionner les approches industrielles, nécessitant praticité, efficacité et réduction des coûts, et les approches académiques, soucieuses d'originalité et de découverte dans un contexte éducatif.
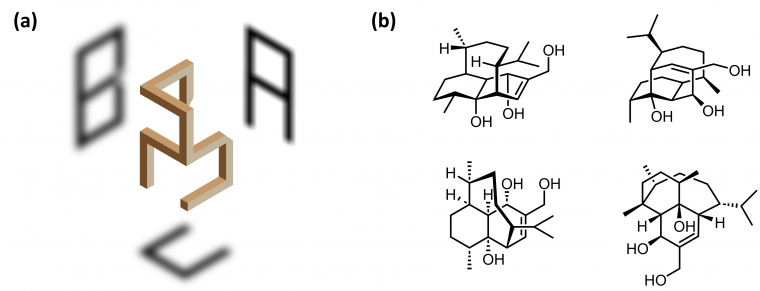
Premier contact visuel avec une structure chimique
On pourrait comparer le premier contact visuel avec une molécule complexe à synthétiser à l'observation d'un ambigramme (Figure 8). Il existe en effet de nombreuses façons de regarder une structure chimique, notamment lorsqu'elle est tridimensionnelle. Selon la perspective d'observation, nous verrons des caractéristiques structurales différentes. De toute évidence, cela peut influencer la conception d'une voie de synthèse ou aider à la compréhension d'une réactivité particulière.
Trois niveaux d'éléments structuraux doivent être considérés lorsqu'on envisage une rétrosynthèse : le squelette carboné, les groupements fonctionnels et la stéréochimie. La stratégie de synthèse dévoilée à l'issue de l'analyse rétrosynthétique devra permettre de construire la molécule-cible en respectant ces trois types d'éléments structuraux.
La synthèse idéale, un idéal toujours poursuivi mais jamais atteint
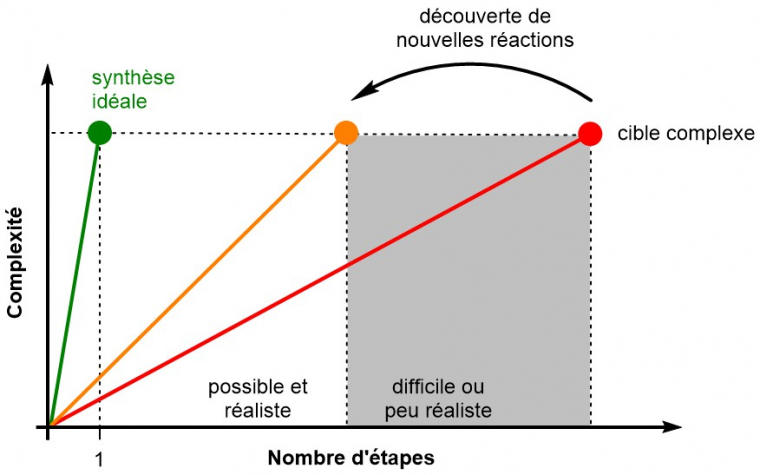
La synthèse idéale est définie comme la synthèse la plus courte (une étape) d'un composé complexe dans les conditions les plus durables, les moins coûteuses et les plus simples, idéalement dans l'eau ou sans solvant et à température ambiante, à partir de matières premières non toxiques et largement disponibles à moindre coût. Ce concept a été théorisé dans les années 1970 par Hendrickson qui ajoutait : « Les matières premières ultimes les plus simples sont les éléments eux-mêmes, matérialisés dans l’idéal classique d’une synthèse à partir de "charbon, d’air et d’eau" » (traduit de : «The ultimate, simplest starting materials are the elements themselves, embodied in the classical ideal of a synthesis from "coal, air and water"») [21]. Des critères de performances peuvent ainsi être définis pour évaluer l'efficacité d'une synthèse totale. Une optimisation de stratégie passera par exemple par la minimisation de l'utilisation de groupements protecteurs, ou par la minimisation des étapes redox non stratégiques (par exemple, la réduction d'un ester en alcool pour le réoxyder plus tard en aldéhyde n'est pas optimale...). La synthèse idéale, même si elle est le plus souvent inaccessible, souligne la nécessité d'une amélioration continue des voies de synthèse, et de la découverte de nouvelles réactions permettant de s'en approcher (Figure 9) [22].
La synthèse totale à l'heure de l'IA
Il est évident que la logique de la synthèse organique autorise un certain degré d'automatisation, allant du calcul de la voie de synthèse la plus efficace à la robotisation des procédés. Comme tous les domaines, la synthèse totale n'échappera pas à l'impact de l'intelligence artificielle (IA). Le terme Chimie 4.0 a d'ailleurs été introduit pour désigner la digitalisation de la chimie et de l'industrie chimique. Si elle peut avoir un impact majeur dans le domaine industriel motivé par l'efficacité et le profit, elle demeure peu considérée aujourd'hui dans les laboratoires académiques pour lesquels les critères d'originalité et de créativité sont essentiels. Il reste à évaluer comment les IA, dont les algorithmes sont entrainés sur des jeux de données existantes, seront capables de faire preuve de créativité en proposant des transformations et des stratégies inédites tout en permettant de faire progresser les connaissances.
Conclusion
La synthèse totale a un but essentiel : celui de préparer des composés d’intérêt, qu’ils soient médicaments ou simples objets d’étude. Au terme de cet exposé, il apparaît pourtant que les enjeux associés à la synthèse totale sont multiples. L’enjeu de la stratégie de synthèse, à travers l’analyse rétrosynthétique en amont d’un projet, va conditionner l’équilibre entre économie et créativité. Dans tous les cas il est nécessaire d’être efficace à moindre coût, tout en étant original, ambitieux et source de nouvelles connaissances, a fortiori en milieu académique. L’enjeu de la synthèse idéale, que nous savons inaccessible, est la quête ultime de tout chimiste organicien cherchant à produire une synthèse courte, efficace, économe et non polluante. Cela conduit au développement permanent de nouvelles méthodes de synthèse, augmentant le champ des possibles. En effet, nous sommes encore très loin de maîtriser toutes les transformations possibles en chimique organique. L’enjeu environnemental, sous-jacent au propos de la synthèse idéale, est actuellement crucial et ne peut que questionner le chimiste dans ses objectifs et le choix de ses méthodes. L’enjeu de l’interdisciplinarité est une piste sérieuse pour motiver la synthèse totale et ses applications. Nos regards se tournent naturellement vers la biologie et la santé. Enfin, l’enjeu de l’acceptabilité des molécules de synthèse dans la société nous renvoie nécessairement à la question : pourquoi, comment et à quel prix doit-on synthétiser ?
Références
[1] Seeman, J. I. The Ways of Science Through the Lens of the Woodward-Hoffmann Rules. The Stories Begin**. Chem. Rec. 2022, e202100211. https://doi.org/10.1002/tcr.202100211.
[2] Seeman, J. I. Fifty Years of a Dispute. A Triptych: Why Woodward? Chem. Rec. 2022, e202200150. https://doi.org/10.1002/tcr.202200150.
[3] Wöhler, F. Ueber Künstliche Bildung Des Harnstoffs. Ann. Phys. 1828, 88 (2), 253–256. https://doi.org/10.1002/andp.18280880206.
[4] Nicolaou, K. C.; Sorensen, E. J. Classics in Total Synthesis: Targets, Strategies, Methods; Wiley‐VCH Verlag, 1996.
[5] Kuttruff, C. A.; Eastgate, M. D.; Baran, P. S. Natural Product Synthesis in the Age of Scalability. Nat. Prod. Rep. 2014, 31 (4), 419–432. https://doi.org/10.1039/C3NP70090A.
[6] Liu, X.-Y.; Qin, Y. Industrial Total Synthesis of Natural Medicines. Nat. Prod. Rep. 2023. https://doi.org/10.1039/D3NP00020F.
[7] Mickel, S. J.; Niederer, D.; Daeffler, R.; Osmani, A.; Kuesters, E.; Schmid, E.; Schaer, K.; Gamboni, R.; Chen, W.; Loeser, E.; Kinder, F. R.; Konigsberger, K.; Prasad, K.; Ramsey, T. M.; Repič, O.; Wang, R.-M.; Florence, G.; Lyothier, I.; Paterson, I. Large-Scale Synthesis of the Anti-Cancer Marine Natural Product (+)-Discodermolide. Part 5: Linkage of Fragments C1-6 and C7-24 and Finale. Org. Process Res. Dev. 2004, 8 (1), 122–130. https://doi.org/10.1021/op034134j.
[8] Yu, M. J.; Zheng, W.; Seletsky, B. M. From Micrograms to Grams: Scale-up Synthesis of Eribulin Mesylate. Nat. Prod. Rep. 2013, 30 (9), 1158–1164. https://doi.org/10.1039/C3NP70051H.
[9] Turconi, J.; Griolet, F.; Guevel, R.; Oddon, G.; Villa, R.; Geatti, A.; Hvala, M.; Rossen, K.; Göller, R.; Burgard, A. Semisynthetic Artemisinin, the Chemical Path to Industrial Production. Org. Process Res. Dev. 2014, 18 (3), 417–422. https://doi.org/10.1021/op4003196.
[10] Ouvrage collectif. Ecologie chimique | Le langage de la nature; CNRS/Cherche Midi, 2012.
[11] Newman, D. J.; Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. J. Nat. Prod. 2020, 83 (3), 770–803. https://doi.org/10.1021/acs.jnatprod.9b01285.
[12] Atanasov, A. G.; Zotchev, S. B.; Dirsch, V. M.; Supuran, C. T. Natural Products in Drug Discovery: Advances and Opportunities. Nat. Rev. Drug Discov. 2021, 20 (3), 200–216. https://doi.org/10.1038/s41573-020-00114-z.
[13] Dewick, P. M. Medicinal Natural Products: A Biosynthetic Approach, 3ème Edition; Wiley, 2009.
[14] Poupon, E.; Nay, B. Biomimetic Organic Synthesis, 2 Volume Set; Wiley‐VCH Verlag, 2011.
[15] Keasling, J. D.; Mendoza, A.; Baran, P. S. A Constructive Debate. Nature 2012, 492 (7428), 188–189. https://doi.org/10.1038/492188a.
[16] Velluz, L.; Valls, J.; Nominé, G. Recent Advances in the Total Synthesis of Steroids. Angew. Chem. Int. Ed. Engl. 1965, 4 (3), 181–200. https://doi.org/10.1002/anie.196501811.
[17] Corey, E. J.; Cheng, X.-M. The Logic of Chemical Synthesis; Wiley, 1995.
[18] Seebach, D. Methods of Reactivity Umpolung. Angew. Chem. Int. Ed. Engl. 1979, 18 (4), 239–258. https://doi.org/10.1002/anie.197902393.
[19] Hanessian, S.; Giroux, S.; Merner, B. L. Design and Strategy in Organic Synthesis: From the Chiron Approach to Catalysis | Wiley; Wiley-VCH, 2013.
[20] Yang, Q.; Njardarson, J. T.; Draghici, C.; Li, F. Total Synthesis of Vinigrol. Angew. Chem. Int. Ed. 2013, 52 (33), 8648–8651. https://doi.org/10.1002/anie.201304624.
[21] Hendrickson, J. B. Systematic Synthesis Design. IV. Numerical Codification of Construction Reactions. J. Am. Chem. Soc. 1975, 97 (20), 5784–5800. https://doi.org/10.1021/ja00853a023.
[22] Wender, P. A.; Verma, V. A.; Paxton, T. J.; Pillow, T. H. Function-Oriented Synthesis, Step Economy, and Drug Design. Acc. Chem. Res. 2008, 41 (1), 40–49. https://doi.org/10.1021/ar700155p.