Cette expérience permet de mettre en évidence le travail électrique stocké sous forme chimique (dans le cas présenté ici, l'énergie provient du fort pouvoir réducteur du magnésium, métastable à l'air en raison d'une couche protectrice de sesquioxyde de magnésium (Mg2O, gris-noir) à sa surface.
Introduction
Cette expérience permet de mettre en évidence le travail électrique stocké sous forme chimique (dans le cas présenté ici, l'énergie provient du fort pouvoir réducteur du magnésium, métastable à l'air en raison d'une couche protectrice de sesquioxyde de magnésium (Mg2O, gris-noir) à sa surface.
Rappelons les valeurs de potentiels standard d'oxydo-réduction :
|
2 H+ (aq) + 2 e- → H2(g) Mg2+ (aq) + 2 e- → Mg (s) Cu2+ (aq) + 2 e- → Cu (s) |
E°1 = 0,00 V E°2 = - 2,37 V E°3 = 0,34 V |
 Sécurité Sécurité |
Attention, lorsque l'on utilise de l'acide sulfurique à une concentration importante, il est recommandé de le manipuler avec des gants et des lunettes. |
Expérience
Protocole expérimental
Le bécher contient une solution électrolytique d'acide sulfurique. Une des bornes d'une lampe-flash est reliée à un morceau de cuivre qui plonge dans la solution. L'autre borne est reliée à un ruban de magnésium préalablement décapé, que l'on plonge par la suite dans la solution.
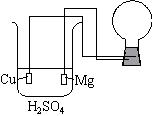
Réalisation de l'expérience
Voir ci-dessous la séquence expérimentale provenant du site Chemical Education administré par l'équipe du Dr. George Bodner.
Observations et interprétations
La lampe flash explose lorsque le magnésium entre en contact avec la solution. En effet, un flux d'électrons est immédiatement créé dans le circuit électriquement fermé, et la ddp aux bornes de la lampe est suffisante pour activer le flash. Le schéma électrique est équivalent à la décharge de la pile :
(-) Mg / Mg2+, HSO4-, H+ / H2 / Cu (+), de f.e.m. standard e° = E°1 - E°2 = + 2,37 V dans la lampe flash.
La réaction de la pile est : Mg (s) + 2 H+ (aq) → Mg2+ (aq) + H2 (g)
Après le flash, on constate :
-
Un dépôt blanchâtre sur le ruban de magnésium, traduisant la formation d'hydroxyde et d'oxyde de magnésium II (forte concentration interfaciale en ions Mg2+ apportés par l'oxydation, et suffisante pour atteindre le Ks de la magnésie MgO et de l'hydroxyde Mg(OH)2, qui se redissolvent moins vite dans le milieu acide sulfurique qu'ils ne se forment).
-
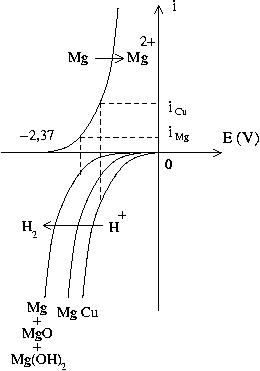
Un fort dégagement gazeux sur le fil de cuivre, qui indique que même après l'explosion de la lampe flash, le circuit reste nécessairement fermé (le cuivre n'est pas attaqué par l'acide sulfurique), et que la réduction de l'hydrogène de l'eau se poursuit en grande partie sur le cuivre, celle-ci étant défavorisée sur le magnésium par la formation des oxyde et hydroxyde non conducteurs. (cf : courbes i-E ci-dessous).
Bibliographie pour approfondir
Marcel Pourbaix Atlas d'équilibres électrochimiques Gauthier-Villars & Cie Editeur, Paris, 1963







