Ce cinquième article du dossier Le stockage de l’énergie électrochimique en technologie Lithium-ion présente les orientations des recherches actuelles dans le domaine des batteries Li-ion. Il présente notamment les batteries Li-ion tout solide et les batteries Li-ion en milieu aqueux, ainsi que la recherche de nouveaux électrolytes, mais aussi les technologies alternatives (batteries Na-ion, batteries Li-air, batteries Li-CO2, batteries rechargeables à flux circulant « redox flow »...).
Le lecteur est invité à consulter au préalable les premiers articles du dossier, intitulés :
Les avancées réalisées ces dernières années visant à améliorer l’autonomie des batteries Li-ion ont été spectaculaires. De plus, l’augmentation considérable des quantités à produire nécessitant la création de « Gigafactory » a permis l’abaissement des coûts de production et une démocratisation des systèmes individuels. Elon Musk, PDG de Tesla, a par exemple souhaité diviser par 3 le prix du kW.h stocké en jouant sur :
- l’effet de volume de production,
- l’intégration de nouvelles variantes de la technologie,
- la possibilité de donner une seconde vie aux batteries en application stationnaire (technologies Powerwall et Powerpack).
Ce prix est ainsi passé de 500 €/kW.h à 150 €/kW.h, cela en utilisant la même technologie de batterie, qui existe depuis presque 15 ans (électrodes NCA/C). Aussi, parallèlement aux nouveaux matériaux d’anode (silicium…) et de cathode (LNMO, matériaux Li-rich…) en cours d’optimisation, de nouvelles orientations sont proposées.
La batterie Li-ion (plus) verte ?
Plusieurs solutions ont été envisagées pour réduire l’emprunte carbone liée à la fabrication des matériaux d’électrode et également l’impact environnemental lié à la toxicité des matériaux. Le matériau LCO (LiCoO2) qui a été intégré comme matériau de cathode dans la première batterie commercialisée (Sony, 1991) et qui contient du cobalt, métal rare, cher et surtout toxique, a fait l’objet d’évolutions pour que le cobalt soit partiellement substitué ou totalement éliminé dans les matériaux de cathodes développés par la suite : on est ainsi passé de 100% dans LCO (LiCoO2) à 33% dans NMC (Li(Ni,Mn,Co)O2) puis 15% dans NCA (Li(Ni,Co,Al)O2) et enfin 0% dans LMO (LiMn2O4) et LFP (LiFePO4). Au sein des générations de batteries NMC pour véhicules électriques les plus récentes, la quantité de cobalt a été drastiquement diminuée au profit du nickel, afin d’augmenter leur capacité spécifique (de ̴ 150 à 200 mA.h.g-1), de NMC 111 où Ni, Mn et Co sont à parts égales, NMC 622, jusqu’à NMC 811 avec 8 Ni pour 1 Mn et 1 Co (NMC 955 dit NMC 90 est à l’étude) se rapprochant ainsi des compositions riches en nickel de type NCA. Ceci a un prix : la température nécessaire pour synthétiser l'oxyde augmente avec la teneur en nickel. Il est toutefois possible de synthétiser ces composés à haute teneur en nickel à température moins élevée en utilisant lors de la synthèse le précurseur LiOH au lieu de Li2CO3.
Les orientations des recherches actuelles consistent :
- à sélectionner des éléments qui soient naturellement abondants,
- à privilégier les méthodes de synthèse par « chimie douce » moins énergivores (basse température par synthèse ionothermale - c’est-à-dire dans un liquide ionique, par opposition à une synthèse hydrothermale, effectuée dans l’eau ou une synthèse solvothermale, effectuée dans un solvant organique - et nanostructuration par des micro-organismes : biominéralisation),
- ou bien encore à développer des électrodes à base de matériaux organiques (à centres redox multiples) renouvelables et issus de la biomasse et
- à développer de nouvelles chimies au-delà du lithium.
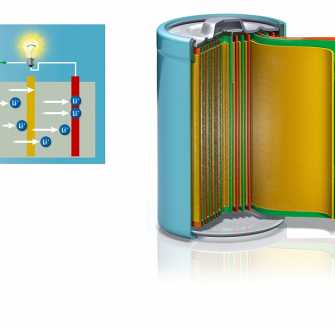
Batterie Li-ion tout-solide
Cette technologie vise à remplacer les électrolytes liquides à base de carbonates organiques (de faible stabilité thermique et électrochimique) par les électrolytes polymères/polymère-gels, ou bien par des matériaux inorganiques ou encore par une combinaison des deux.
Figure adaptée de Materials 12 (2019) 3892
Ceci permet une amélioration de la sécurité mais aussi une augmentation des densités énergétiques accessibles de par l’utilisation possible de matériaux de cathode à plus haut potentiel et la densité plus élevée des empilements de matériaux pouvant être produits (l’électrolyte joue aussi le rôle de séparateur, les électrodes sont bipolaires). Le dépôt des matériaux d’anode, d’électrolyte solide et de cathode en fines couches successives permettent notamment le développement de batteries en couches minces flexibles (100 µm d’épaisseur) présentant un intérêt pour des nombreuses applications (médicale, prêt-à-porter…).
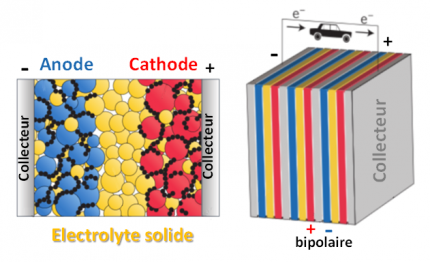
Electrodes bipolaires
Dans les batteries tout-solide, de fines couches de matériaux composites de cathode et d’anode (et de carbone et couches protectrices) sont déposées sur l’électrolyte solide (un verre céramique ou bien un polymère), l’ensemble présentant une épaisseur de quelques centaines de microns. L’assemblage en configuration bipolaire, dans lequel les matériaux d’électrode (+) et (-) sont de part et d’autre d’un même conducteur métallique, permet une compacité optimale des modules de batteries produits.
Les électrolytes solides inorganiques utilisés, en verre céramique à base d’oxyde (grenats dopés : LLZO, NASICONs : LATP Ohara Glass©, LISICONs et perovskites lacunaires : LLTO) ou bien à base de sulfure (LGPS, thioLISICONs et Argyrodite, présentent une meilleure conductivité ionique à température ambiante que leur pendant polymère (10-4 - 10-3 S.cm-1 contre 10-6 - 10-5 S.cm-1 à 25 °C), proche de celle des électrolytes organiques liquides. Il est à noter cependant que de nouveaux électrolytes polymères à base de dérivés de PEO (réseau polymère interpénétrant obtenu par mélange avec le poly(acrylate d’éthyle) ipn-PEA), de polyéthylène glycol (PEG) ou de polyméthyl méthacrylate (PMMA), présentant une bonne conductivité à 25°C ainsi qu’une stabilité électrochimique accrue (4-5 V vs Li+/Li), sont envisagés également.
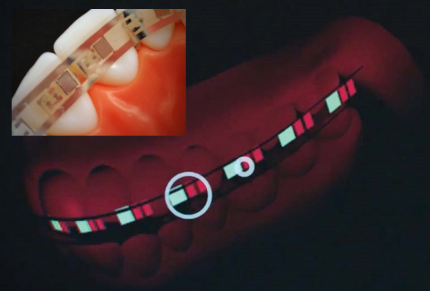
Ce type de dispositif permet l'amélioration de la régénération des os et réduction des coûts de traitement.
Dans ces batteries tout-solide, la compatibilité chimique des électrolytes solides vis-à-vis des électrodes positives et négatives ainsi que la maîtrise des interfaces (résistance de contact et de joint de grain) représentent des défis importants à relever.
Les batteries tout-solide très fines présentent une flexibilité intéressante lorsqu’elles sont couplées à « l’électronique flexible » (voir Figure 2).
Batterie Li-ion en milieu aqueux
Ces systèmes (1994) qui visent à remplacer les électrolytes carbonates organiques par des électrolytes aqueux dans le cadre du développement durable et pour des raisons évidentes de sécurité sont extrêmement limités en termes de densité d’énergie (< 100 W.h. kg−1), étant donnée la fenêtre étroite de stabilité électrochimique de l’eau (1,23 V) et le choix limité de matériaux d’électrodes qui peuvent être utilisés (pour l’électrode négative surtout). Les recherches actuelles consistent à la fois à travailler sur la chimie de surface des matériaux (enrobages hydrophobes) et sur la composition de l’électrolyte afin de ralentir la cinétique d’oxydation/réduction de l’eau sur les matériaux actifs, à l’instar de la batterie au plomb dont le potentiel de fonctionnement est de 2V mais dont l’autodécharge (réduction de H+ sur Pb et oxydation de H2O sur PbO2 en milieu H2SO4) est cinétiquement lente. Une nouvelle classe d’électrolytes aqueux superconcentrés permettant d’étendre la fenêtre électrochimique au-delà de 3V (c’est-à-dire d’élargir le domaine de travail qui est actuellement 1,9 - 4,9 V vs Li+/Li) est envisagée à la fois pour les technologies Li-ion mais aussi pour les technologies compétitives (Li-S).
Figure adaptée de Electrochem. Comm. 104 (2019) 106488
Ces électrolytes, dits eau dans le sel (« water-in-salt electrolyte » : WISE) sont constitués à plus de 20 mol.L-1 en sel, souvent LiTFSI. Dans ces sels de type imide, les anions organiques volumineux et faibles acides de Lewis interagissent faiblement avec les ions Li+, promouvant leur solvatation par l’eau. Ils permettent aussi, lors de leur décomposition, la formation d’une SEI stable à l’électrode négative à base de fluorures alcalins. Le recours à des mélanges eutectiques de sels imides dont certains asymétriques (PTFSI : N(SO2CF3)(SO2C2F5)−) permet l’obtention de mixtures di voire monohydratées (55,5 mol.kg-1) dont la fenêtre électrochimique peut être étendue à 5V, élargissant ainsi le spectre des matériaux d’électrode utilisables.
L'électrolyte "water-in-salt"
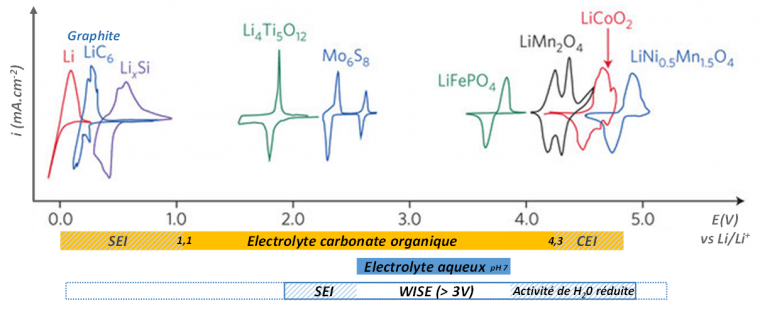
Ces électrolytes aqueux superconcentrés en sels de lithium de type imide (LiN(SO2CF3)2), noté LiTFSI, ou LiN(SO2F)2 , noté LiFSI, typiquement à 21 mol.L-1 mais reportés jusqu’à 55,5 mol.kg-1 dans le cas de mélanges eutectiques de sels, présentent une faible réactivité pour l’oxydation de l’eau et une capacité à former une SEI. La fenêtre électrochimique des électrolytes aqueux produits est ainsi considérablement étendue permettant le fonctionnement des matériaux classiquement utilisés en technologie Li-ion avec toutefois des performances en cyclage limitées.
Les différents électrolytes sont l'électrolyte carbonate organique type LP30 (EC/DMC, LiPF6 1 mol.L-1), l'électrolyte aqueux (pH7, domaine plus étendu que l’eau pure), et l'électrolyte superconcentré de type WISE « eau dans sel ». La fenêtre de stabilité au contact des matériaux peut être étendue par la formation de couches semi-passives (SEI et CEI).
Figure adaptée de Nat Energy 1 (2016) 16129.
La recherche de nouveaux électrolytes ininflammables fonctionnant à températures extrêmes
La recherche sur les électrolytes pour les accumulateurs aux ions lithium au sein de l'entreprise SAFT consiste à adapter la chimie des électrolytes, par l’accord des compositions en solvants, additifs, sels de lithium et polymères avec la chimie des couples d’électrodes (anode et cathode associées), avec l’application visée (en matière d’énergie et de puissance) et avec l’environnement de l’accumulateur (température d’utilisation, vibrations et chocs, surcharge, sécurité). Aux contraintes de performances s’ajoutent régulièrement des exigences fortes en matière de coût pour les futures applications, notamment automobiles : < 10 $/kg pour un électrolyte formulé. SAFT ajuste finement les compositions de ses électrolytes, aussi bien aux applications de masse que de spécialité, en agissant sur les propriétés physico-chimiques de l’électrolyte « bulk », sur les chimies interfaciales en analysant les mécanismes de formation de SEI et de CEI, et sur la structuration de l’électrolyte (solvatation des ions). Ce type d’approche est illustré dans les deux points ci-après.
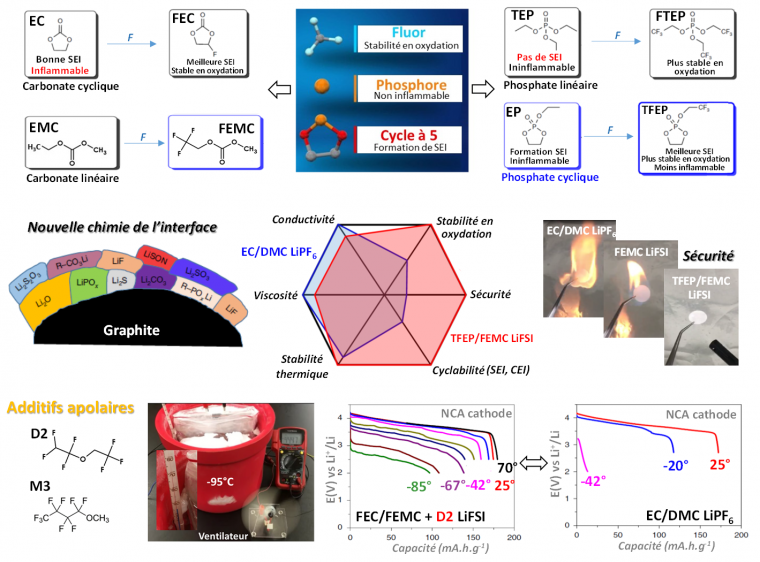
Jouer sur les chimies des interfaces
La compréhension toujours plus poussée des compositions et des propriétés des interfaces (SEI et CEI) autorise maintenant le développement de chimies innovantes, plus performantes et plus sûres, d’électrolytes liquides. Le concept de modification des interfaces électrodes/électrolyte par le design chimique des additifs et des solvants (ADSM, Additives for Designed Surface Modification) a été pour la première fois introduit par Brett L. Lucht et développé depuis pour dessiner de nouvelles molécules, par exemple en combinant les propriétés de passivation par la formation d’une SEI des carbonates cycliques avec celles de phosphates organiques ayant la capacité de piéger les radicaux d’hydrogène et éviter la combustion de l’électrolyte. Des composés tels que les phosphates cycliques ont ainsi vu le jour. Cette approche est aujourd’hui caractéristique de la recherche sur les électrolytes Li-ion.
Les électrolytes fluorés comme « super-électrolytes »
Par ailleurs, la fluoration des solvants (FEC, FEMC, TFEP) et l’utilisation de sels dont l’anion comprend un fluor labile (LiFSI : LiN(SO2F)2) permet d’élargir la fenêtre électrochimique des électrolytes obtenus (de 0 V à 4,3 V) et d’étendre significativement la durée de vie d’accumulateurs Li-ion et au lithium métal. Ces nouveaux électrolytes permettent ainsi de pallier les déficiences des électrolytes classiques (faible conductivité ionique à basse température, instabilité en oxydation, inflammabilité, et cyclabilité limitée de matériaux haute-tension comme NMC, NCA, LNMO). L’addition de composées apolaires fluorés (D2, M3) aux électrolytes fluorés permet l’obtention de super-électrolytes dont les propriétés physiques et chimiques, dissociées de leurs propriétés électrochimiques, peuvent être ajustées. Ces électrolytes fortement fluorés autorisent le fonctionnement des accumulateurs sur un domaine de températures extrêmement large allant de -95°C à +70°C et sont ininflammables. Ces électrolytes fluorés représentent donc une voie de recherche encourageante dans la conception d’électrolytes sûrs opérant dans un domaine de températures élargi.
Au-delà du Lithium-ion - Les technologies compétitives
Sont présentées succinctement ci-dessous et résumées sur la Figure 8 les technologies ayant fait ou faisant l’objet d’une attention particulière ces dernières années pour concurrencer voire supplanter la technologie Lithium-ion. Les effets d’annonce concernant la maturité des dispositifs mis au point ainsi que les projections fantaisistes associées à la levée des verrous technologiques permettant le développement à grande échelle de ces technologies alternatives ont pu donner lieu à de grandes déconvenues à la fois dans le monde académique mais aussi industriel.
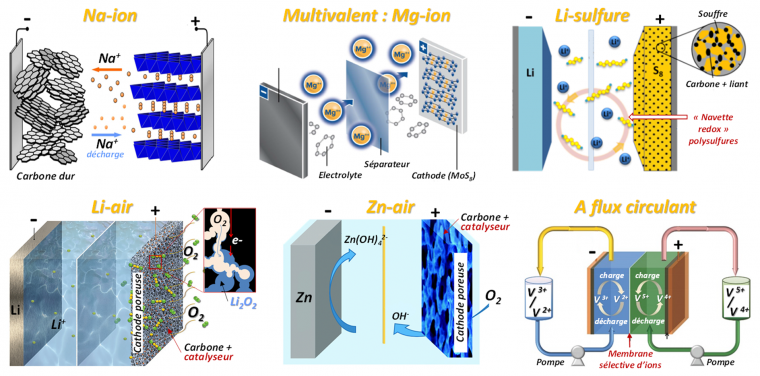
Les batteries Na-Ion
Les batteries Sodium-ion représentent une alternative attrayante et plausible au Li-ion en dépit de leur densité énergétique plus faible (vrai en technologie Na-métal : rayon ionique et masse plus élevés du sodium, potentiel moins électronégatif que celui du lithium : -2,71 V vs ESH) notamment par l’abondance naturelle élevée du sodium, 1000 fois supérieure à celle du lithium. Si la technologie Na-ion très proche de celle du Li-ion profite des développements opérés ces dernières années, elle possède ses propres verrous technologiques dont certains ont pu être déjà levés. La découverte de carbones durs (320 mA.h.g-1 à 0,3 V Na+/Na) a ainsi permis de pallier le faible taux d’insertion du sodium dans le graphite (NaC64 contre LiC6). De plus, des matériaux de cathodes polyanioniques à base de vanadium (fluorophosphate de vanadium NVPF Na3V2(PO4)2F3 : ̴ 120 mA.h.g-1 à 3,9 V vs Na+/Na montrant une bonne stabilité en cyclage ont été introduits, ainsi que des analogues de bleu de Prusse (Na2MnFe(CN)6, ̴ 150 mA.h.g-1 à 3,4V). De plus des électrolytes à base de carbonate de propylène (PC) moins inflammables que les combinaisons EC/DEC et EMC, ainsi que des collecteurs de courant en aluminium à l’anode, moins chers et moins lourds que ceux en cuivre (pas d’alliage entre le sodium et l’aluminium), peuvent être utilisés en technologie Na-ion. La faible solubilité des sels de sodium et l’instabilité des interfaces au contact des électrolytes actuellement utilisés restent problématiques. Les premiers prototypes de batteries Na-ion apparaissent pourtant à travers le monde et notamment en France, introduits par le CEA et le réseau français sur le stockage électrochimique de l’énergie (RS2E) du CNRS et actuellement développés par la start-up Tiamat (prototypes 18650 chargeable en 5 minutes).
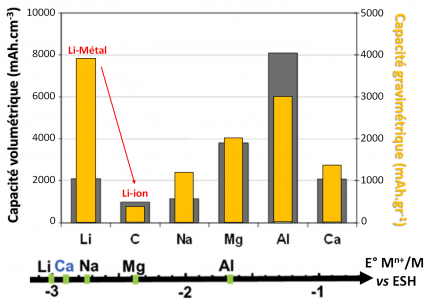
Batteries à ions à valence multiple
Ces batteries utilisant des anodes métalliques ou bien fonctionnant sur le principe « rocking-chair » précédemment décrit, font intervenir des cations divalents (Mg2+, Ca2+) voire trivalents (Al3+) présentant une abondance bien supérieure à celle du lithium (on rappelle que Al, Ca, Mg et Li sont respectivement les 3e, 5e, 7e et 33e éléments les plus abondants sur terre) et surtout permettant l’échange de 2 et 3 électrons, intéressant en termes de capacité (volumique particulièrement). La formulation d’électrolytes et la maîtrise de l’interface électrode/électrolyte représentent deux défis importants à relever pour développer ce type de batteries.
Figure adaptée de : Energy Storage Materials 20 (2019) 253–262
Ces éléments multivalents utilisés sous leur forme métallique du côté anodique seraient moins prompts à former des dendrites que le lithium, mais la formation de couches passives ayant une faible conductivité ionique au contact de l’oxygène ou des électrolytes « classiques », ainsi que la « lente » (dé)solvatation de ces ions lors de l’insertion/désinsertion sont problématiques. Du coté cathodique, les matériaux pouvant intercaler de façon réversible ces ions multivalents sont difficiles à trouver, la charge élevée de ces derniers pouvant déstabiliser la structure : en effet, les rayons ioniques de Ca2+ (100 pm) et Na+ (102 pm) sont proches, tout comme ceux de Mg2+ (72 pm) et Li+ (76 pm), Al3+ a un rayon bien plus petit : 53 pm. Les matériaux opérant via des réactions de conversion (Mg-S) ou bien des matériaux organiques (batteries Al-organique) ont donc été envisagés. Pour les batteries Mg-ion, pour lesquelles les recherches sont peut-être les plus avancées, des matériaux d’anode à base d’alliages (Mg3Bi, MgIn) ou de chalcogénures (phase de Chevrel MgxMo6S8) ont été proposés.
Propriétés énergétiques d’ions multivalents
Les électrodes métalliques utilisant des métaux multivalents présentent des capacités spécifiques volumétriques intéressantes, jusqu’à 4 fois supérieures à celle du Li métal (ou du Li-ion dans le cas d’anodes en graphite : LiC6). Cependant leur potentiel de fonctionnement est moins négatif que celui du lithium (Ca2+/Ca : 170 mV, Mg2+/Mg : 670 mV, Al3+/Al : 1,38 V vs Li+/Li), ce qui nécessite de trouver des matériaux d’électrode positive à potentiel de fonctionnement d’autant plus haut.
Batteries Li-S
Avec du lithium métal à l’anode et des polysulfures S8 à la cathode (composite de carbone et liant polymère) et un fonctionnement reposant sur une réaction de conversion 16 Li+ + S8 + 16 e- ⇋ 8 Li2S, les batteries lithium-sulfure présentent une capacité théorique élevée (1165 mA.h.g-1), un potentiel moyen de 2,15 V vs Li+/Li et donc une densité d’énergie théorique importante ( ̴ 2 500 kW.kg-1). Ces batteries souffrent cependant d’une forte perte de capacité lors du cyclage de par la forte expansion volumique (+78%) associée à la formation de Li2S à la cathode et de par la solubilité des polysulfures formés (Li2S4, Li2S6, Li2S8) ; on parle de « navette rédox» pour décrire la solubilité de ces espèces et leur transport et leur réactivité à l’anode pendant la charge. Ces batteries, introduites dès les années 1960, ne sont par conséquent toujours pas commercialisées. L’utilisation d’oxydes conducteurs tels que Ti4O7 ou de polymères (DiAllylDiMéthylAmmonium : DADMA) a été proposée pour piéger les polysulfures. Les électrolytes classiquement utilisés pour les batteries Li-ion sont incompatibles et sont remplacés par des mélanges d’éthers cycliques (1,3-dioxolane) et linéaires à courte chaîne (méthoxyméthane) avec le sel LiTFSI.
Batteries Li-air (O2)
Ces batteries, dont le principe de fonctionnement est connu depuis les années 1970, utilisent dans le cas d’électrolytes aprotiques (sels LiPF6, LiTFSI ou LiCF3SO3 : LiOTf et solvants EC/PC) du lithium métal à l’anode et une cathode poreuse en carbone permettant la réduction de l’oxygène de l’air (en quantité illimitée) en radical superoxyde O2- selon le mécanisme 2 Li+ + 2 e- + O2 ⇋ Li2O2 (avec une étape intermédiaire possible Li+ + 1 e- + O2 ⇋ LiO2 ) et bénéficient donc d’énergie théorique presque dix fois supérieure à celle des batteries Li-ion (3 450 W.h.kg-1 calculée pour Li2O2 soit 3840 mA.h.g-1). Plusieurs verrous technologiques ont bloqué jusqu’ici le développement de la technologie Li-air :
- l’attaque nucléophile sur les électrolytes organiques de type carbonate par le radical superoxyde formé en décharge ainsi que corrosion du lithium à l’anode par ce même radical (partiellement résolue par un revêtement de Li2CO3),
- l’accumulation (encrassement) à la cathode de Li2O2(pouvant réagir avec CO2 et H2O de l’air),
- la corrosion du carbone à la cathode utilisée aux potentiels nécessaires pour réoxyder le Li2O2 formé en décharge.
La protection du carbone par des couches (MoS2) permettant l’oxydation catalytique de Li2O2 a été proposée comme solution. En dépit des promesses miraculeuses et des espoirs de percées technologiques autour du Li-air ces deux dernières années, aucune solution commerciale n’a encore vu le jour. Déjà en 2010, J.M. Tarascon, professeur au collège de France, statuait ainsi lors de sa leçon inaugurale : « Il n’en demeure pas moins que la technologie Li-air qui rassemble dans un même système nos deux échecs vis-à-vis de l’électrochimie, à savoir notre incapacité à maîtriser une électrode de Li et celle à contrôler l’électrode à oxygène (problème identique à celui rencontré pour les piles à combustible), est très loin de son état de maturation ».
Batteries Zn-air (O2)
La technologie Zn-air, vieille d’un siècle (commercialisée dès 1932 sous forme primaire), est très prometteuse étant donnée sa densité d’énergie théorique élevée (1353 W.h.kg-1), la sécurité inhérente à sa conception (solvant aqueux) et son coût très faible (potentiellement jusqu’à 10 dollars par kW.h contre 150 dollars par kW.h pour la technologie Li-ion). À l’image de la technologie Li-air, les batteries Zn-air sont composées d’une anode en zinc métallique et d’une cathode poreuse à l’air, séparées par une membrane et mises au contact d’un électrolyte aqueux alcalin concentré (6 mol.L-1). Alors que le zinc est oxydé pendant la décharge en ions zincates, l’oxygène est réduit sur un catalyseur à la cathode, et ce de façon réversible : O2 + 4 e- + 2 H2O ⇋ 4 OH- et Zn + 4 OH-⇋ Zn(OH)42- + 2 e-. La batterie Zn-air existe sous sa forme rechargeable (secondaire) depuis 2012 mais avec une faible densité d’énergie ( ̴ 35 kW.h.kg-1) qui peut être expliquée par :
- la corrosion de l’anode en zinc (avec dégagement de H2),
- la formation de dendrites,
- la cinétique lente de réduction (« Oxygen Reduction Reaction» : ORR) et de dégagement de l’oxygène (« Oxygen Evolution Reaction » : OER) notamment avec les catalyseurs non-nobles employés.
La difficulté pour les systèmes rechargeables réside dans la nécessité de combiner deux types de catalyseurs, un pour les réactions OER et l’autre pour les réactions ORR. Comme pour la technologie Li-air, les conditions électrochimiques requises pour réaliser les réactions OER donnent lieu à une corrosion du carbone et des métaux employés dans les catalyseurs. Les recherches actuelles consistent donc à stabiliser l’anode en zinc (nanostructuration, revêtement et alliage) et à optimiser les catalyseurs (carbones dopés, catalyseurs dits « à atome unique » Fe-N-C ou Co-N-C, spinelles ou pérovskites).
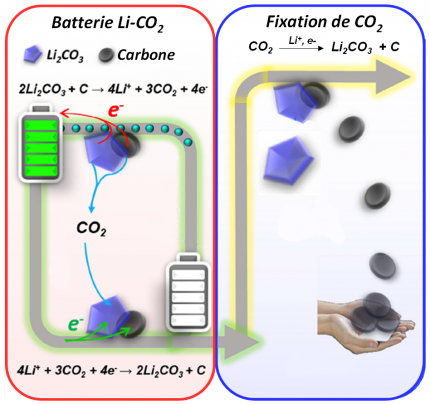
Batteries Li-CO2
Cette batterie, dont la première version opérationnelle a été mentionnée en 2019, fonctionne au dioxyde de carbone et est proposée comme une des solutions possibles de valorisation du CO2. La batterie Li-CO2 possède une capacité théorique de 1876 Wh.kg-1 (Li-ion : 100-265 Wh.kg-1) basée sur la réaction 2 Li(s) + 3/2 CO2(g) = Li2CO3(s) + 1/2 C(s). Elle utilise un matériau d’électrode positive poreux composite à base de carbone permettant la diffusion de CO2, du lithium métallique comme électrode négative et un électrolyte à base de liquide ionique (EMIM-BF4 1-ethyl-3-methylimidazolium tetrafluoroborate), de solvant organique (DMSO) et de sel de lithium fluoré (LiTFSI).
Figure adaptée de Joule 1 (2017) 359-370.
La réaction à l’électrode positive convertissant pendant la recharge le carbonate de lithium solide Li2CO3(s) en CO2(g) selon la réaction : 2 Li2CO3(s) + C(s)⇋ 3 CO2(g) + 4 Li+ + 4e- doit être catalysée par des nanomatériaux mélangés au carbone tels que des nanofeuillets de MoS2 (voir le 2ème article du dossier), qui sont des matériaux rares (les nanotubes de carbone « Carbon nanotubes » CNT ou bien les structures organométalliques « Metal Organic Framework » MOF sont des alternatives possibles). Les batteries sont proposées en association avec des systèmes permettant la « fixation » du CO2 atmosphérique, comme des électrolyseurs alimentés par la décharge de la batterie Li-CO2, permettant la réduction de CO2(g) en produits solides valorisables (Li2CO3(s) et C(s)).
Batteries rechargeables à flux circulant (« redox flow »)
Le fonctionnement de ces batteries introduites dès les années 1970 par la NASA repose sur la circulation en continu à partir de réservoirs indépendants (anolyte et catholyte) d’espèces redox (en solutions aqueuses) réagissant, lors de la charge ou de la décharge, aux électrodes qui sont séparée par une membrane sélective d’ions (souvent en Nafion©, chère ! Le Nafion, polymère conducteur ionique développé par la société Dupont, est un polymère fluoré (à base de polytétrafluoroéthylène : PTFE) et sulfoné (présence de groupes -SO3H). Les groupes sulfonate -SO3- assurent le transport efficace par « saut » des protons partiellement solvatés par l’eau au travers de la membrane de Nafion). Pour ces systèmes, la densité d’énergie et la densité de puissance sont donc découplées et peuvent être modulées par le changement de la taille des réservoirs et des électrodes respectivement. Les systèmes à flux circulant principaux développés jusqu’ici, « Vanadium » et « Zinc-Brome », basés respectivement sur les couples V3+/V2+ (-) et V5+/V4+ (+) et Zn2+/Zn (-) et Br2/Br- (+) présentent de faibles densités d’énergie (20-50 W.h.kg-1) dues notamment à leur faible potentiel de fonctionnement en milieu aqueux (1,4 et 1,85 V respectivement). Les recherches actuelles portent sur la suppression des membranes en utilisant des flux laminaires d’anolyte et de catholyte aux électrodes limitant leur mélange, ou bien des anolytes aqueux et catholytes organiques non miscibles. Une autre voie explore les systèmes redox non-aqueux (molécules organiques dont les propriétés redox peuvent être ajustées) ou encore les électrolytes aqueux fortement concentrés en sels pouvant fonctionner à 2 voire 3 V (1,2 V pour les électrolytes aqueux dilués).
Images adaptées de : Na-ion - MRS Bulletin 39 (2014) 416-422 - Mg-ion : Korab Resources Limited, Lithium & Battery Metals Conference 2018, Li-S : Greencarcongress2018, Li-air : Adv. Sustainable Syst. 1 (2017) 1700036, Zn-air : J. Mater. Chem. A, 5 (2017) 7651, Flux circulant : Adv. Mater. Interfaces, 3 (2016) 1500309.
Une liste des acronymes utilisés dans tout le dossier, ainsi qu'une version au format PDF de cet article sont fournies ci-après.
Documents à télécharger