Cette expérience permet de mettre en évidence la possibilité de changer le sens d'évolution d'un système chimique en imposant un courant. On va ici s'intéresser à l'électrolyse de l'eau (transformation forcée). A la fin de l'expérience, on mettra en évidence la production équivalente d'ions oxonium et d'ions hydroxyde au cours de l'électrolyse de l'eau.
Introduction
Cette expérience permet de mettre en évidence la possibilité de changer le sens d'évolution d'un système chimique en imposant un courant.
On va ici s'intéresser à l'électrolyse de l'eau (transformation forcée). A la fin de l'expérience, on mettra en évidence la production équivalente d'ions oxonium et d'ions hydroxyde au cours de l'électrolyse de l'eau.
Expérience
Protocole expérimental
On réalise le montage schématisé ainsi :
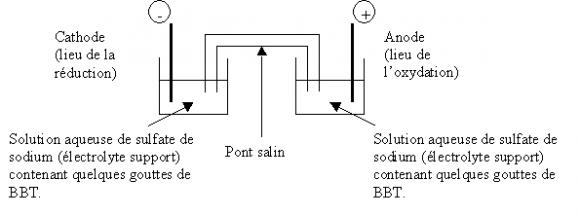
Deux petits cristallisoirs sont remplis d'une solution aqueuse de sulfate de sodium (Na2SO4) à laquelle on a ajouté quelques gouttes de Bleu de bromothymol (BBT). Ils sont reliés l'un à l'autre par un pont salin. Les deux électrodes, respectivement dans chacun des deux cristallisoirs, sont reliées à un générateur de courant.
On allume le générateur et on laisse l'électrolyse se faire.
Après un long temps d'électrolyse, on éteint le générateur et on transvase les deux solutions, contenues dans chacun des cristallisoirs, dans un bécher.
Réalisation de l'expérience
Voir ci-dessous la séquence expérimentale provenant du site Chemical Education administré par l'équipe du Dr. George Bodner.
Observations et interprétations
Avant d'allumer le générateur, on observe que les deux solutions contenues dans les cristallisoirs sont vertes, teinte prise par le BBT lorsque la solution est neutre (pH = 7).
Une fois l'électrolyse lancée, on observe que les solutions contenues dans les cristallisoirs prennent des teintes différentes. A la cathode, la solution devient bleue, teinte prise par le BBT en milieu basique, et à l'anode, la solution devient jaune, teinte prise par le BBT en milieu acide. Il y a donc production d'ions oxonium à l'anode et d'ions hydroxyde à la cathode. Voici les équations des réactions ayant lieu aux électrodes :
- A l'anode (lieu de l'oxydation) : 2 H2O(l) → O2(g) + 4 H+(aq) + 4 e-
- A la cathode (lieu de la réduction) : 2 H2O(l) + 2 e- → H2(g) + 2 OH-(aq)
Comme il y a une quantité égale d'électrons transférés à l'anode et à la cathode, l'électrolyse de l'eau produit une quantité équivalente d'ions oxonium et d'ions hydroxyde. On le vérifie expérimentalement en mélangeant, à la fin de l'électrolyse, les solutions contenues dans chacun des cristallisoirs. En effet, on observe une teinte finale verte correspondant à la neutralité de la solution.
L'équation bilan de l'électrolyse de l'eau est donc : 2 H2O (l) → O2(g) + 2 H2(g)
Bibliographie pour approfondir
- J. Sarrazin et M. Verdaguer L'oxydoréduction, concepts et expériences. Ed. Ellipses, 1991
- C. Rochaix Electrochimie. Ed. Nathan, Paris, 1996
- M. Bernard et F. Busnot Usuel de chimie générale et minérale Ed. Dunod.
- J. Badoz-Lambing, G. Charlot, B. Tremillon Les réactions électrochimiques, les méthodes électrochimiques Ed Masson, 1993
- A.J. Bard et L.R. Faulkner Méthodes électrochimiques Ed. Masson, 1983