Ce deuxième article du dossier L'AFM-IR : présentation et exemples d'application montre l'utilisation de cette technique dans la recherche de nouveaux traitements contre le cancer du sein. Le lecteur est invité à consulter au préalable le premier article du dossier, intitulé Couplage de la microscopie à force atomique (AFM) et de la spectroscopie infrarouge (IR) : AFM-IR.
Introduction
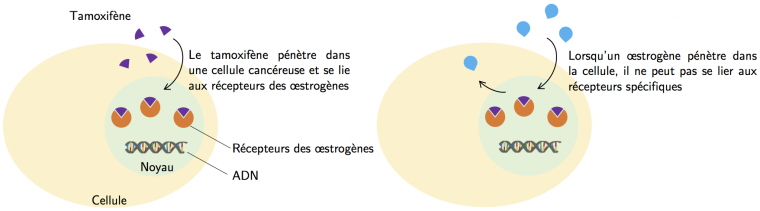
Le cancer du sein est un des cancers féminins les plus fréquents : il touche une femme sur 8 et 60 000 nouveaux cas sont recensés chaque année en France. On distingue différents types de cancers du sein chez la femme : les cancers hormono-dépendants, c’est-à-dire les cancers pour lesquels des hormones (par exemple les œstrogènes) favorisent la prolifération des cellules cancéreuses (60 à 70 % des cancers du sein) et les cancers du sein non hormono-dépendants (30 à 40 % des cas). Dans le cas d’un cancer hormono-dépendant, les cellules cancéreuses sont sensibles à certaines hormones sexuelles féminines secrétées par les ovaires (comme les œstrogènes). Lorsqu’une hormone de ce type se fixe aux récepteurs d’une cellule, il y a activation de la transcription de gènes responsables de la prolifération cellulaire (Figure 1). S’agissant ici de cellules cancéreuses, cette hormone stimule leur multiplication, ce qui favorise le développement d’une tumeur.
Développement de complexes organométalliques pour le traitement du cancer du sein
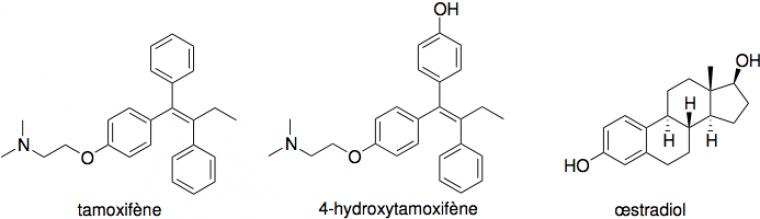
Le tamoxifène (Z-2-[4-(1,2-diphényl-1-butényl)phénoxy]-N,N-diméthyléthanamine), découvert à la fin des années 1950 par Arthur Walpole, est la molécule la plus souvent prescrite à des patientes diagnostiquées d'un cancer du sein hormono-dépendant. Dans ce type de cancer, le récepteur des œstrogènes est impliqué dans la prolifération des cellules cancéreuses. L'action antiproliférative de la forme hydroxylée du tamoxifène, l'hydroxytamoxifène, est due à une liaison compétitive au récepteur des œstrogènes, qui réprime la transcription de l'ADN provoquée par l'œstradiol (figure 2).
Malheureusement, le tamoxifène n'a pas d'action sur certaines cellules cancéreuses du sein, soit parce qu'elles n'expriment pas le récepteur aux œstrogènes, soit parce qu'elles ont développé une résistance au tamoxifène.
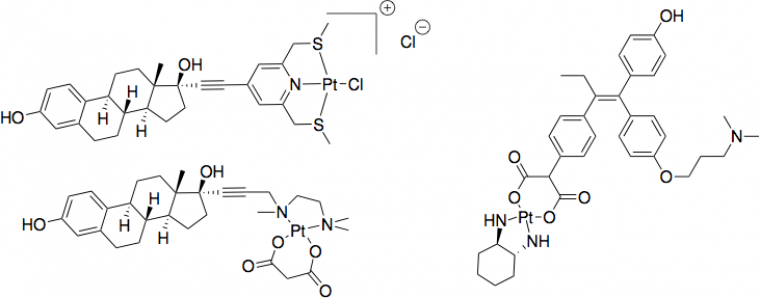
La découverte des propriétés anticancéreuses du cis-platine (cis-[PtCl2(NH3)2]) dans les années 1960 a révolutionné le traitement du cancer des testicules et a mené à un renforcement de la recherche de complexes organométalliques servant d'agents antitumoraux, c’est-à-dire luttant contre une tumeur. En revanche, le cis-platine n'est jamais prescrit pour le traitement du cancer du sein en raison de sa faible efficacité sur les cellules de cancer du sein. Ainsi, des complexes dérivés du cis-platine et possédant une bonne affinité pour le récepteur aux œstrogènes ont été synthétisés (Figure 3).
Cependant, aucun de ces complexes n'a produit d'effet positif quant au ciblage de cellules de cancer du sein hormono-dépendant.
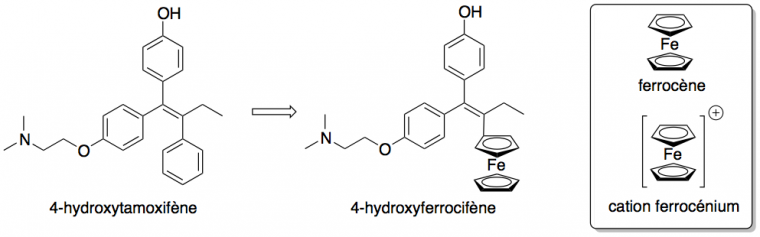
Pour lutter contre les deux formes de cancer du sein, des molécules possédant les deux fonctions (anti-œstrogénécité et cytotoxicité indépendante des œstrogènes) ont été développées. La cytotoxicité d’une molécule désigne sa capacité à être toxique pour des cellules. Ainsi, lorsqu'un groupement phényle d'un composé de type tamoxifène est remplacé par un ferrocène (Figure 4), l'hydroxyferrocifène alors obtenu possède une cytotoxicité supérieure à l'hydroxytamoxifène correspondant, en raison de la cytotoxicité du cation ferrocénium Fc+.
Le métal de l'unité organométallique peut être modifié : des dérivés avec du ruthénium ou du rhénium ont également été synthétisés. Ces complexes organométalliques sont stables en milieu biologique et sont solubles dans l'éthanol et le diméthylsulfoxyde (DMSO), ce qui est intéressant pour des applications biologiques. Ils ont une bonne affinité pour les récepteurs des œstrogènes et possèdent une lipophilicité supérieure à l'œstradiol ou à l'hydroxytamoxifène.
Étude sur des dérivés du tamoxifène
Pour quantifier la capacité d’un composé à inhiber une action biologique, on détermine une grandeur appelée concentration inhibitrice médiane, ou IC50. C’est la concentration pour laquelle ce composé inhibe la moitié de l’action biologique ciblée. Plus la valeur du IC50 est élevée, moins le composé est efficace.
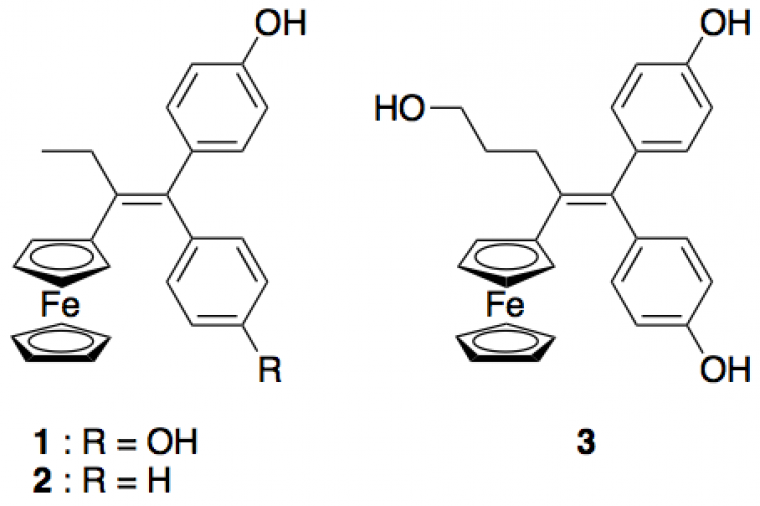
Dans la famille des ferrocifènes, le complexe diphénol 1 (Figure 5) a été décrit comme l'une des molécules les plus efficaces ayant un effet antiprolifératif, à la fois in vitro sur différentes lignées cellulaires (IC50 = 0,65 µmol·L–1 dans des cellules cancéreuses du sein de la lignée MDA-MB-2311) et in vivo sur l'inhibition de la croissance de tumeurs cérébrales.
Plus récemment, un autre complexe, l'hydroxypropylferrociphénol 3 (Figure 5), a montré un effet antiprolifératif in vitro sur cellules MDA-MB-231 supérieur à celui de 1 (IC50 = 0,11 µmol·L–1).
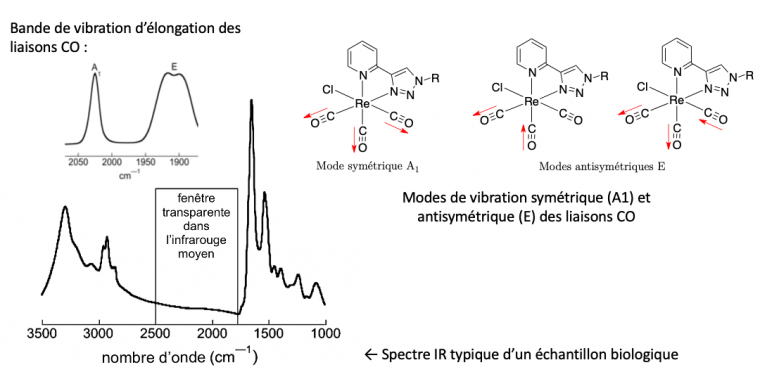
Afin de détecter des molécules d'intérêt dans des cellules, de nombreux marqueurs greffables ont été développés ; la plupart d'entre eux sont des marqueurs fluorescents. Cependant, les ferrocènes sont connus pour éteindre la luminescence, ce qui peut empêcher l'application de cette méthode dans ce cas. D'autres techniques spectroscopiques d'imagerie n'impliquant pas la désexcitation d’états excités peuvent être envisagées. C'est le cas de la spectroscopie infrarouge qui se révèle être une méthode de choix. L'équipe de Clotilde Policar, à l’École normale supérieure, a développé l'utilisation de la spectroscopie IR et des sondes IR utilisables dans ce contexte. Elle a montré que l'utilisation de groupements de type métal-tricarbonyle (possédant trois groupements carbonyle CO) permet de marquer et de localiser des composés d'intérêt en milieu cellulaire, en raison des bandes de vibrations d'élongation symétrique (bande A1) et antisymétrique (bande E dédoublée) situées dans la fenêtre transparente des cellules (entre 1800 et 2100 cm–1) (Figure 6).
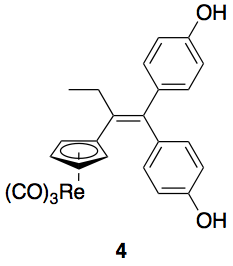
Cette méthode a été initialement appliquée au 1,1-di(4-hydroxyphényl)-2-cyrhetrenylbut-1-ène, un composé organométallique dans lequel une unité [(Cp)Re(CO)3] (Cp désignant le cyclopentadiène) est liée à une structure de type hydroxytamoxifène (composé 4, Figure 7).
Le dérivé marqué du tamoxifène 4 a été incubé dans des cellules du cancer du sein MDA-MB-231 à une concentration d'incubation de 10 µmol·L–1. Ensuite, les cellules ont été imagées, d'abord par AFM-IR, puis par spectromicroscopie FTIR utilisant le rayonnement synchrotron (SR-FTIR-SM).
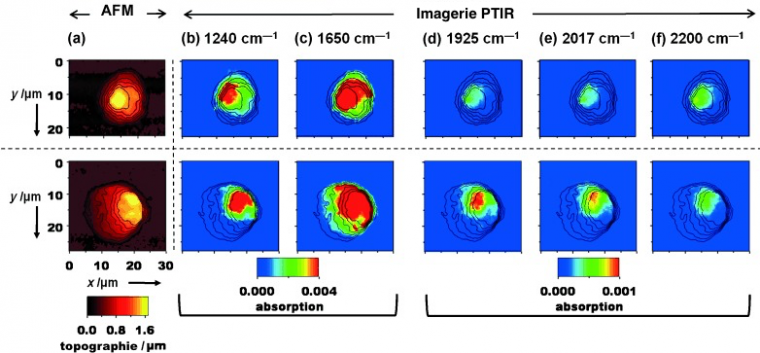
Pour voir la distribution du composé 4 par AFM-IR, les cellules incubées et les cellules témoins ont été déposées sur un prisme de ZnSe. Elles ont d'abord été identifiées par la topographie (Figure 8(a)) puis des cartes ont été enregistrées à différents nombres d'onde (Figure 8(b-f)) : 1240 cm–1 (phosphate), 1650 cm–1 (amide I), 1925 et 2017 cm–1 (tricarbonyle) et 2200 cm–1 (témoin négatif).
(a) Topographie AFM, (b-f) Cartes enregitrées en AFM-IR à (b) 1240 cm-1 (phosphate), (c) 1650cm-1 (amide I), (d) 1925cm-1, (e) 2017 cm-1 (tricarbonyle) (f) 2200 cm-1 (en dehors d'une bande).
À ces trois derniers nombres d'onde, les cellules témoins présentent un signal très faible, qui est attribué à l'absorption de l'eau. En revanche, pour les cellules traitées, des signaux importants attribués au composé 4 ont été enregistrés à 1925 et 2017 cm–1, ce qui confirme que le produit a pénétré dans la cellule. Le signal de 4 étant co-localisé avec celui des bandes à 1240 cm-1 (vibration d'élongation antisymétrique de PO2–) et à 1650 cm–1 (bande amide I), des signaux caractéristiques du noyau de la cellule, on peut conclure à une localisation nucléaire pour ce dérivé du tamoxifène.
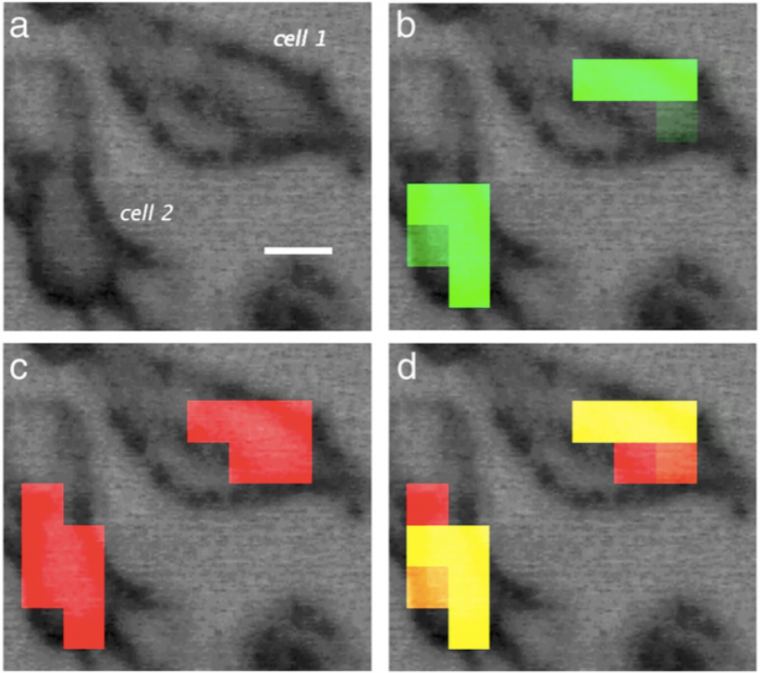
Afin de mettre en évidence la pertinence de cette technique innovante et de confirmer les résultats obtenus, des expériences similaires ont été réalisées par SR-FTIR-SM et imagerie de fluorescence. Des cartes ont été enregistrées par mesure de l’aire de bandes infrarouge spécifiques : la bande E (1939-1902 cm–1) correspond aux vibrations d'élongation antisymétriques des fonctions CO et la bande amide-I (1711-1583 cm–1) est caractéristique du noyau. La mesure de l’aire des bandes en infrarouge est pertinente, car elle est proportionnelle à la quantité de produit. L'aire des deux bandes étudiées est maximale au même endroit dans la cellule : on peut donc confirmer par SR-FTIR-SM la localisation nucléaire pour ce dérivé du tamoxifène (Figure 9).
(a) Image visible (Barre d'échelle = 10 µm)
Cartes SR-FTIR-SM : (b) Bande E des fonctions carbonyle (vert), (c) Bande des fonctions amide-I (rouge), (d) Superposition des deux signaux.
D'après Clède, S., Lambert, F., Sandt, C., Gueroui, Z., Delsuc, N., Dumas, P., Vessières, A., and Policar, C., Synchrotron radiation FTIR detection of a metal-carbonyl tamoxifen analog. Correlation with luminescence microscopy to study its subcellular distribution, Biotechnology Advances 2013, 31(3), 393–395.
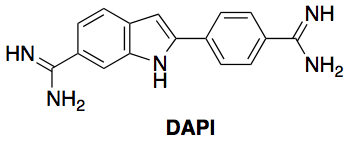
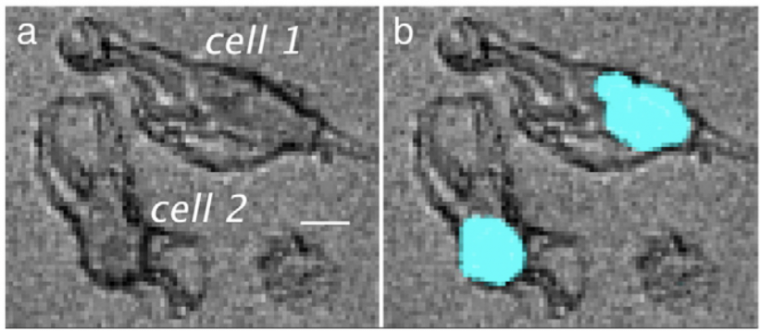
Enfin, les noyaux ont été marqués par une solution de DAPI (4,6-diamidino-2-phénylindole, Figure 10), molécule fluorescente connue pour marquer spécifiquement les noyaux des cellules par liaison aux base adénine et thymine de l’ADN, et observés par microscopie de fluorescence (excitation à 350 ± 50 nm, émission à 460 ± 50 nm).
Cette expérience permet de comparer la localisation dans les cellules de la molécule 4 et celle du DAPI, que l’on sait nucléaire. On constate ici que ces deux molécules sont localisées au même endroit dans la cellule, ce qui permet de confirmer l'accumulation du composé 4 dans le noyau des cellules (Figure 11) 1.
D'après Clède, S., Lambert, F., Sandt, C., Gueroui, Z., Delsuc, N., Dumas, P., Vessières, A., and Policar, C., Synchrotron radiation FTIR detection of a metal-carbonyl tamoxifen analog. Correlation with luminescence microscopy to study its subcellular distribution, Biotechnology Advances 2013, 31(3), 393–395.
Bibliographie
- Murugesapillai, D., McCauley, M.J., Maher, L.J., and Williams, M.C., Single-molecule studies of high-mobility group B architectural DNA bending proteins, Biophysical Reviews 2017, 9 (1), 17–40.
- Henry, L., Bacle, P., and Rossi-Gendron, C., La Microscopie à Force Atomique pour l’observation de molécules avec une résolution atomique 2016
- Binnig, G., Quate, C.F., and Gerber, C., Atomic Force Microscope, Physical Review Letters 1986, 56 (9), 930–933.
- Policar, C., Waern, J., Plamont, M., Clède, S., Mayet, C., Prazeres, R., Ortega, J.M., Vessières, A., and Dazzi, A., Subcellular Imaging in the Mid-IR of a Metal-Carbonyl Moiety Using Photothermal Induced Resonance, Angewandte Chemie International Edition 2011, 50, 860–864.
- Dazzi, A. and Prater, C.B., AFM-IR : Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging, Chemical Reviews 2017, 117 (7), 5146– 5173.
- Dazzi, A., Kjoller, K., and Reading, M., High Frequency Deflection Measurement of IR Absorption 2008.
- Dazzi, A., Konstantin, V., Policar, C., Reading, M., Kjoller, K., and Prater, C.B., High Frequency Deflection Measurement of IR Absorption 2012.
- Dazzi, A. and Policar, C., Chapter 9 - AFM-IR : photothermal infrared nanospectroscopy : Application to cellular imaging, in C. Pradier and Y. Chabal, editors, Biointerface Characterization by Advanced IR Spectroscopy, pages 245 – 278, Elsevier, Amsterdam 2011, doi :https://doi.org/10.1016/B978-0-444-53558-0.00009-6.
- Dazzi, A., Prater, C.B., Hu, Q., Chase, D.B., Rabolt, J.F., and Marcott, C., AFM- IR : Combining Atomic Force Microscopy and Infrared Spectroscopy for Nanoscale Chemical Characterization, Applied Spectroscopy 2012, 66 (12), 1365–1384.
- Dazzi, A., PhotoThermal Induced Resonance. Application to Infrared Spectromicroscopy, in Thermal Nanosystems and Nanomaterials, pages 469–503, Springer Berlin Heidelberg 2009, doi :10.1007/978-3-642-04258-4_16.
- Dazzi, A., Glotin, F., and Carminati, R., Theory of infrared nanospectroscopy by photothermal induced resonance, Journal of Applied Physics 2010, 107 (12), 124519.
- Prater, C.B., Kjoller, K., Shetty, R., and Dazzi, A., Spectroscopy : AFM improves resolution of IR spectroscopy, Laser Focus World 2011, 47, 52–54.
- Mayet, C., Deniset-Besseau, A., Prazeres, R., Ortega, J.M., and Dazzi, A., Analysis of bacterial polyhydroxybutyrate production by multimodal nanoimaging, Biotechnology advances 2013, 31 (3), 369–374.
- Dazzi, A., Prazeres, R., Glotin, F., and Ortega, J., Subwavelength infrared spectro- microscopy using an AFM as a local absorption sensor, Infrared Physics & Technology 2006, 49 (1), 113 – 121.
- Mayet, C., Dazzi, A., Prazeres, R., Allot, F., Glotin, F., and Ortega, J.M., Sub-100 nm IR spectromicroscopy of living cells, Optics Letters 2008, 33 (14), 1611.
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J.M., and Jaillard, D., In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy, Analyst 2010, 135, 2540–2545.
- Dazzi, A., Prazeres, R., Glotin, F., and Ortega, J.M., Local infrared microspectroscopy with subwavelength spatial resolution with an atomic force microscope tip used as a photothermal sensor, Optics Letters 2005, 30 (18), 2388.
- Hillard, E., Vessières, A., Thouin, L., Jaouen, G., and Amatore, C., Ferrocene- Mediated Proton-Coupled Electron Transfer in a Series of Ferrocifen-Type Breast-Cancer Drug Candidates, Angewandte Chemie International Edition 2006, 45 (2), 285–290.
- Keppler, B.K., Metal Complexes in Cancer Chemotherapy, Wiley-VCH, Weinheim 1993.
- Jackson, A., Davis, J., Pither, R.J., Rodger, A., and Hannon, M.J., Estrogen-Derived Steroidal Metal Complexes : Agents for Cellular Delivery of Metal Centers to Estrogen Receptor-Positive Cells, Inorganic Chemistry 2001, 40 (16), 3964–3973.
- Top, S., Kaloun, E.B., Vessières, A., Leclercq, G., Laïos, I., Ourevitch, M., Deuschel, C., McGlinchey, M.J., and Jaouen, G., Tamoxifen Derivatives for Delivery of the Antitumoral (DACH)Pt Group : Selective Synthesis by McMurry Coupling, and Biochemical Behaviour, ChemBioChem 2003, 4 (8), 754–761.
- Cassino, C., Gabano, E., Ravera, M., Cravotto, G., Palmisano, G., Vessières, A., Jaouen, G., Mundwiler, S., Alberto, R., and Osella, D., Platinum(II) and technetium(I) complexes anchored to ethynylestradiol : a way to drug targeting and delivery, Inorganica Chimica Acta 2004, 357 (7), 2157 – 2166.
- Jaouen, G., Top, S., Vessières, A., Leclercq, G., and McGlinchey, M.J., The First Organometallic Selective Estrogen Receptor Modulators (SERMs) and Their Relevance to Breast Cancer, Current Medicinal Chemistry 2004, 11 (18), 2505–2517.
- Jaouen, G., Vessières, A., and Top, S., Ferrocifen type anti cancer drugs, Chemical Society Reviews 2015, 44 (24), 8802–8817.
- Wang, Y., Pigeon, P., Top, S., McGlinchey, M.J., and Jaouen, G., Organometallic Antitumor Compounds : Ferrocifens as Precursors to Quinone Methides, Angewandte Chemie International Edition 2015, 54 (35), 10230–10233.
- Fery-Forgues, S. and Delavaux-Nicot, B., Ferrocene and ferrocenyl derivatives in luminescent systems, Journal of Photochemistry and Photobiology A : Chemistry 2000, 132 (3), 137 – 159.
- Hostachy, S., Policar, C., and Delsuc, N., Re(I) carbonyl complexes : Multimodal platforms for inorganic chemical biology, Coordination Chemistry Reviews 2017, 351, 172–188.
- Clède, S. and Policar, C., Metal-carbonyl units for vibrational and luminescence imaging : towards multimodality, Chemistry - A European Journal 2015, 21 (3), 942–58.
- Hildebrandt, P., A Spectral Window to the Cell, Angewandte Chemie International Edition 2010, 49(27), 4540–4541.
- Clède, S., Lambert, F., Sandt, C., Kascakova, S., Unger, M., Harte, E., Plamont, M.A., Saint-Fort, R., Deniset-Besseau, A., Gueroui, Z., Hirschmugl, C., Lecomte, S., Dazzi, A., Vessieres, A., and Policar, C., Detection of an estrogen derivative in two breast cancer cell lines using a single core multimodal probe for imaging (SCoMPI) imaged by a panel of luminescent and vibrational techniques, Analyst 2013, 138 (19), 5627–38.
- Clède, S., Lambert, F., Sandt, C., Gueroui, Z., Delsuc, N., Dumas, P., Vessières, A., and Policar, C., Synchrotron radiation FTIR detection of a metal-carbonyl tamoxifen analog. Correlation with luminescence microscopy to study its subcellular distribution, Biotechnology Advances 2013, 31 (3), 393–395.
- Wang, Y., Heinemann, F., Top, S., Dazzi, A., Policar, C., Henry, L., Lambert, F., Jaouen, G., Salmain, M., and Vessières, A., Ferrocifens labelled with an infrared rhenium tricarbonyl tag : synthesis, antiproliferative activity, quantification and nano IR mapping in cancer cells, Dalton Transactions 2018, 47, 9824–9833.
- Zhong, Q., Inniss, D., Kjoller, K., and Elings, V., Fractured polymer/silica fiber surface studied by tapping mode atomic force microscopy, Surface Science Letters 1993, 290b(1-2), L688–L692.
- Surfaces, B.N., Tapping AFM-IR Provides High-Resolution Chemical Imaging 2019.
- Mathurin, J., Pancani, E., Deniset-Besseau, A., Kjoller, K., Prater, C.B., Gref, R., and Dazzi, A., How to unravel the chemical structure and component localization of individual drug-loaded polymeric nanoparticles by using tapping AFM-IR, Analyst 2018, 143 (24), 5940–5949.